有机硫化学

有机硫化合物(organosulfur compounds)指含有硫元素的有机化合物,有机硫化学即是研究有机硫化合物的有机化学分支。有机硫化合物广泛存在于自然界中,具有特征性的令人讨厌的气味(例如大蒜素),但少数也带甜味(例如糖精)。很多化石燃料,如煤、天然气、石油中,都含有一定数量的有机硫化合物,燃烧时会释放出有毒的二氧化硫气体。为避免污染,脱硫已成为石油炼制中很重要的一个环节。
按质量计,人体中硫元素占0.25%,[1] 绝大多数以有机硫化合物的形式存在。20种常见氨基酸中,也有两种含有硫元素,分别是半胱氨酸和甲硫氨酸;抗生素青霉素和磺胺类药物也都是有机硫化合物。
硫与氧,硒和碲共享氧族元素,和它被预计有机硫化合物与碳-氧,碳-硒,和碳-碲化合物具有相似性。
用于检测硫化合物的经典化学试验是Carius卤素法。
硫属于氧族元素,硫和氧具有相似的价电子层结构,有机硫化合物在某些程度上与有机含氧化合物有些相似,例如它们都可生成醇/硫醇、醚/硫醚等。但和氧原子相比,硫是第三周期元素,原子半径较大,电负性较小,且3d轨道也可以成键。因此,硫原子还可以形成一系列常见的四价及六价有机硫化合物,如亚砜、砜、亚磺酸和磺酸。它们都不存在对应的含氧化合物。
分类[编辑]
有机硫化合物可根据硫原子的价数、配位数或氧化数来进行分类。下面列出的是按价数分类的有机硫化合物种类:
| 二价硫化合物(-S-、=S): | 四价硫化合物: | 六价硫化合物: |
例子[编辑]
硫醇[编辑]
硫醇是一类通式为R-SH的化合物,其中-SH称巯基。低级的硫醇有强烈且令人讨厌的气味,但臭味随碳数增多而减弱,高级硫醇具有令人愉快的气味。它们是醇的含硫对应化合物,但相比之下,硫醇的酸性[2] 和亲核性更强,更易被氧化。在空气、碘、氧化铁、二氧化锰等弱氧化剂作用下,硫醇氧化得到二硫化物:
- 2R-SH -[O]→ R-S-S-R + H2O
金属锂在液氨中,以及氢化铝锂或锌加酸都可使二硫化物还原为硫醇/硫酚。硫醇与二硫化物互相转化的氧化还原反应是生物体内常见现象之一,半胱氨酸经氧化转化为胱氨酸即是一例。二硫化物中含有的二硫键(-S-S-)是维持蛋白质空间结构的重要化学键之一。
强氧化剂(如高锰酸钾、硝酸、高碘酸)作用下,硫醇氧化经过中间产物次磺酸、亚磺酸,最终得到磺酸。催化加氢条件下,硫醇失硫生成相应的烃。工业上,因为硫会使一般的催化剂(如雷尼镍)中毒,这一步脱硫常在二硫化钼或二硫化钨等含硫催化剂的作用下进行,一个例子是由噻吩催化加氢制取四氢噻吩。
硫醇与羧酸反应成硫醇酯,与醛生成缩硫醛,与酮生成缩硫酮。后两个反应一般用于羰基的保护,保护基缩硫醛/酮具有特殊有用的极性翻转性质。
硫醚[编辑]
硫醚是一类通式为R-S-R的化合物。相比醚,硫醚中的C-S键键能较低,容易断裂,有时可以形成稳定的含硫自由基。硫原子含有两对孤对电子,具亲核性和碱性,可与浓硫酸或卤代烷成锍盐。锍盐经氢氧化银和水作用转化为氢氧化三烷基锍,有强碱性,加热分解为硫醚和烯烃。
硫醚也可被多种氧化剂(如过氧化氢)氧化,中间产物是亚砜,最终产物是砜。高碘酸和间氯过氧苯甲酸可使氧化反应停留在亚砜的阶段。此外,催化加氢也可使硫醚中的C-S键断裂,生成烷烃。
亚砜、砜[编辑]
亚砜和砜是通式分别为R-S(=O)-R和R-S(=O)2-R的化合物。硫原子为sp3杂化态,S=O键为强极性键,硫带部分正电荷,氧带部分负电荷,具亲核性。α-氢具酸性。两个烃基不同的亚砜有手性,有些可以被拆分出来。
亚砜很容易被氧化剂(例如过氧乙酸、四氧化二氮、高碘酸钠、间氯过氧苯甲酸等)氧化为砜,被还原则得到硫醚。它也有弱碱性,可与强酸成盐。
磺酸、亚磺酸[编辑]
磺酸和亚磺酸是通式分别为R-S(=O)2-OH和R-S(=O)-OH的化合物。磺酸为强酸,可以和金属氢氧化物反应生成稳定的盐,烃基芳香磺酸盐常用作洗涤剂。其衍生物包括磺酰氯、磺酸酯和磺酰胺,都是很重要的产物:磺酰氯如对甲苯磺酰氯,是有机合成中常用的试剂;磺酸酯中的磺酰氧基是很好的离去基团;磺酰胺衍生物中有很多则是重要的消炎药物,如磺胺类的磺胺嘧啶、磺胺胍等等。
亚磺酸具有中等的酸性,可被空气氧化为磺酸,被锌和盐酸还原为硫醇,与卤代烷生成砜。它们由格氏试剂与二氧化硫反应制备。
硫叶立德[编辑]
硫叶立德是一类通式为R2S+-−CR2的化合物,最常见的是亚甲基硫叶立德。它们由锍盐在碱作用下失去HX而得到,属于较稳定的两性离子型化合物,碳带负电荷,有较强的亲核性。硫叶立德是比较常用的有机合成试剂,它们与醛、酮、α,β-不饱和醛酮反应生成环氧乙烷衍生物,与双键碳原子上连有酯基、硝基、氰基等吸电子基的烯烃反应生成环丙烷的衍生物。
硫烷、高价硫烷[编辑]
硫烷和高价硫烷通式为SR4及SR6,母体SH4、SH6在理论上是存在的,但极为不稳定。1990年时制得了同族的碲的六甲基化合物(Te(Me)6),用的是二氟化氙与Te(Me)2F2反应,再用二乙基锌处理。[3] 类似的SMe6据计算是稳定的,[4] 但尚未制得。
硫烷类型的四价有机硫化合物稳定性不高,最常用的是二乙氨基三氟化硫(DAST)。它是常用的氟化试剂,可作四氟化硫的替代品,与醇、醛和酮反应时,氧原子变为氟,得到有机氟化合物。
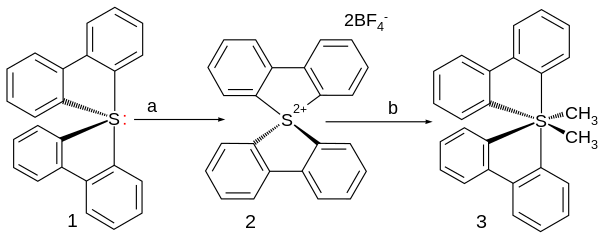
首个不含其他杂原子的高价硫烷于2006年制得,其中的硫原子与两个联苯配体及两个顺式甲基相连。[5] 它是由二联苯硫(IV)作原料,使其与二氟化氙/三氟化硼在乙腈中反应,而后用丁基锂在四氢呋喃中处理得到。C-S键长在189-193pm之间,硫为变形八面体结构。
合成[编辑]
有机硫化合物中的硫原子可以通过多种方法引入,常见的途径包括:
- 以硫氢化钠中的硫氢根离子(HS−)作亲核试剂,通过双分子亲核取代反应合成硫醇。硫醇可作其他有机硫化合物的合成原料,比如它在碱性条件下转化为硫醇负离子,与卤代烃反应,便可引入另一个烷基,得到硫醚;
- 劳氏试剂与羰基化合物反应,将其转化为硫羰基化合物。用此方法,醛酮转化为硫醛/硫酮,酰胺转化为硫代酰胺,1,4-二羰基化合物环合生成噻吩环,等等;
- 用十硫化四磷、硫化氢或其他硫化物将原料中的氧转化为硫,依此,酰胺/腈和酮可分别被转化为硫代酰胺和硫酮。用十硫化四磷在加温下与1,4-二羰基化合物反应,环化制得噻吩类化合物,称为帕尔-克诺尔合成(Paal-Knorr合成):

- 六甲基二硅硫烷与含氧或氯的有机物反应,借助硅元素对这两种元素的亲合力,将原料转化为相应的含硫有机化合物。六甲基二硅硫烷由硫化钠与三甲基氯硅烷反应制备;
- 通过二硫化碳引入硫原子,同时增加一个碳,例如用醇和二硫化碳制备黄原酸酯;
- 用硫氰酸钾或硫氰酸铵与RX(X为较好的离去基团)反应,制得硫氰酸酯及异硫氰酸酯。
参见[编辑]
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
参考资料[编辑]
- ^ Thomas J. Glover, comp., Pocket Ref, 3rd ed. (Littleton: Sequoia, 2003), p. 324 (LCCN 2002-91021), which in turn cites Geigy Scientific Tables, Ciba-Geigy Limited, Basel, Switzerland, 1984.
- ^ Organosulfur chemistry. reviews of current research JANSSEN, M.J. Interscience, New York,(1967)
- ^ Synthesis and characterization of hexamethyltellurium(VI) Latif Ahmed, John A. Morrison J. Am. Chem. Soc.; 1990; 112(20); 7411-7413. 摘要 (页面存档备份,存于互联网档案馆)
- ^ The S6 Point Group Conformers of the Hexamethylchalcogens: Me6S, Me6Se, Me6Te Fowler, J. E.; Schaefer, H. F., III; Raymond, K. N. Inorg. Chem.; (Article); 1996; 35(2); 279-281. doi: 10.1021/ic940240d
- ^ Isolation and Molecular Structure of the Organo-persulfuranes [12-S-6(C6)] Sato, S.; Matsunaga, K.; Horn, E.; Furukawa, N.; Nabeshima, T. J. Am. Chem. Soc.; (Communication); 2006; 128(21); 6778-6779. doi:10.1021/ja060497y
外部链接[编辑]
- 牛津大学网站上的有机硫化学专题 (页面存档备份,存于互联网档案馆)(英文)
|
