氧氮環丙烷
| 此條目需要編修,以確保文法、用詞、语气、格式、標點等使用恰当。 (2013年7月11日) |
| 氧氮環丙烷 | |
|---|---|

| |
| IUPAC名 Oxaziridine | |
| 系统名 Oxaziridine[1] | |
| 识别 | |
| CAS号 | 6827-26-5 |
| PubChem | 15817734 |
| ChemSpider | 10614170 |
| SMILES |
|
| 性质 | |
| 化学式 | CH3NO |
| 摩尔质量 | 45.04 g·mol−1 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |

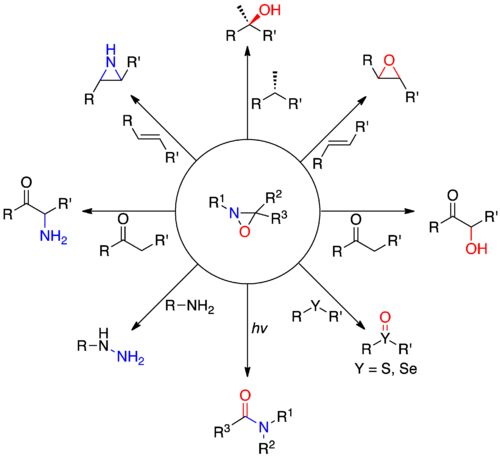
氧氮環丙烷是一类有机分子,特点是含有氧、氮、碳的三元杂环。氧氮環丙烷的衍生物通常作為各種不同氧化反應的試劑,包括烯醇的α-羥基化、烯烃的环氧化与氮杂环丙化、和其他的雜原子轉移反應。氧氮環丙烷也可以用於合成有用的中間物來進行醯胺的重組反應,以及與多種累积多烯化合物進行[3 +2]環加成反應得到五元杂环。手性氧氮環丙烷衍生物可以影響非對稱性的氧原子的轉移,將其生成物引導為前手性的烯醇類化合物。另一些氧氮環丙烷具有较高的翻转势垒,可以使氮原子產生手性。
歷史[编辑]
氧氮環丙烷在20世紀50年代中期由埃蒙斯(Emmons)[2]首次合成 ,隨後克里姆(Krimm)[3]、霍納(Horner)和尤爾根(Jürgens)[4]也相继合成了该类化合物。尽管氧和氮由於具有高電負性通常作為親核試劑,氧氮環丙烷中却允許雜原子進行親電子轉移。這種不常見的反應是由於存在高張力的三元環和相對較弱的N-O鍵。當氮上的取代基上較小時,親核試劑傾向於进攻环上的氮原子(R1= H);而當氮上的取代基具有位阻效應時,親核試劑則會进攻氧原子。氧氮環丙烷這種特別的電子轉移方式可以用在一些氧和氮的轉移反應上,包括烯醇的α-羥基化、烯烴環氧化、硫化物与硒化物的選擇性氧化、含氮亲核试剂的胺化、酰胺氮的胺化等。
手性的樟脑磺基氧氮环丙烷(Camphorsulfonyloxaziridines)是一种实用的氧氮环丙烷,可应用于复杂产物的合成,如商用化疗药物紫杉醇(taxol)。霍尔顿(Holton)紫杉醇合成和文德尔(Wender)紫杉醇合成中均使用樟脑磺基氧氮环丙烷进行了不对称α-羟基化反应。
合成[编辑]
N-H、N-烷基、N-芳基氧氮环丙烷[编辑]
N-H、N-烷基、N-芳基氧氮环丙烷合成的兩種主要方法是过氧酸氧化亞胺(A)或羰基化合物的胺化(B)。

除此之外,手性亞胺的氧化以及手性过氧酸氧化亞胺的反應會生成光学纯的氧氮環丙烷。一些氧氮環丙烷可以在室温下产生构象稳定的氮原子,其翻转势垒高达100~130 kJ/mol,由此得到的光学纯氧氮环丙烷已有报道。[5]
N-磺基氧氮环丙烷[编辑]
在20世纪70年代末和80年代初,F. A. Davis首次合成了N-磺基氧氮环丙烷,并将其用作氧轉移試劑。它也是目前使用最多的氧氮环丙烷化合物。[6] N-磺基氧氮环丙烷原先是用mCPBA和相轉移催化劑芐基三甲基氯化銨(benzyltrimethylammonium chloride)合成,現在常用過硫酸氫鉀作為氧化劑。[7]
目前有多种N-磺基氧氮环丙烷(如下表所示),它们在性质与反应性上有着轻微的差别。[8][9][10][11][12][13][14][15][16]

全氟代氧氮環丙烷[编辑]
由于全氟代烷取代基有很高的吸电子能力,全氟代氧氮環丙烷比起普通的氧氮环丙烷,其反应性更接近于双环氧乙烷。[17] 全氟代氧氮環丙烷可以由全氟亞胺与过氧氟甲酰三氟甲酯反应制得,反应需要金属氟化物吸收反应中的氟化氢。[17]

氧氮環丙烷的反應[编辑]
氧轉移[编辑]
烯醇的α-羥基化[编辑]
α-羥基酮(或偶姻)是许多天然產物中的重要组成部分。合成α-羥基酮的方法包括還原α-二酮、羥基取代離去基團、和烯醇的直接氧化。氧代双過氧化鉬(吡啶)-(六甲基磷酰胺)(MoOPH)和N-磺基氧氮环丙烷是该反應中最常見的親電子氧的来源。相比于MoOPH和其他氧化剂,N-磺基氧氮环丙烷的優點是其对产物更高的手性诱导能力。[18] 在α-羟基化中使用Evans手性助剂并将N-磺基氧氮环丙烷作为亲电试剂,可以获得高产率(77-91%)和高非对映比(95:5 - 99:1)。

此外,使用樟脑磺基氧氮环丙烷的衍生物对前手性烯醇进行不对称羟基化也可得到适中甚至较高的对映体过剩率。[11]一般認為决定产物立体化学性質的开放过渡态是由R1的空間位阻決定的。[8]

有趣的是,當氧氮环丙烷的α位有配位基团(如上表的3b和3c)时,有些羥基化反应的选择性會急剧上升。[14]在這些例子中,一般认为反应是通過封闭过渡态進行的,其中金属氧化物由硫酸和樟脑骨架上的配位原子所穩定。[8]

利用氧氮环丙烷进行α-羥基化合成已經在全合成中得到广泛使用。例如,霍爾頓紫杉醇全合成和文德紫杉醇全合成。這些反應中,氧氮环丙烷的α-羥基化合成均是一個關鍵的步驟。此外,福賽斯(Forsyth)在冈田酸C3-C14片段的合成中也成功地利用了此法。[19]

烯烴環氧化[编辑]
烯烴的環氧化反應在有機合成中是一種多用途的合成技術,因为環氧化合物可以產生出其他有用的官能團。实验室中通常使用mCPBA或其他過酸進行環氧化反應。研究发现,氧氮环丙烷可以生成對酸高度敏感的環氧化物。[5]如 進行 (-)-Chaetominine的合成時,在最后一步可利用氧氮環丙烷進行还氧化反應(如下圖所示)。[20]

不对称环氧化是另一种广泛使用的合成方法。在文獻中有許多不對稱環氧化反应,例如Sharpless环氧化、Jacobsen-Katsuki环氧化和Juliá-Colonna环氧化。這些方法仅对特定的官能团存在反应选择性。Sharpless环氧化針對烯丙醇、Jacobsen环氧化需要順式二取代基烯烃作為反應物,Juliá环氧化则是针对α-β不飽和酮。不對稱氧氮雜環丙烷試劑利用足夠的非對稱誘導,可以对许多无官能团修饰的烯烃产生立体选择性。[5] 此外Lusinichi等也研究了使用当量的過硫酸氫鉀和手性氧氮环丙烷进行如下所示的不對稱環氧化。[21]

无活性碳氫化合物的羥基化[编辑]
全氟代氧氮环丙烷可以用于羟基化无活性的碳氢化合物,并有着顯著的區域選擇性和非对映特异性。[17]考虑到该氧化剂是非金屬试剂,鲜有類似的反應可以有该反应一般高的转化率。全氟待氧氮环丙烷對於三級氫有著高選擇性。反应中没有观察到一級碳的羟基化,具有两个可氧化位点时也没有观察到二羟基化。反应的立体选择性极高(95 - 98%),且加入金属氟化物可以使其进一步提高。[22]

氮轉移[编辑]
現在已經相當少將氧氮雜環丙烷作為氮轉移試劑使用。氧氮雜環丙烷和未取代或醯基化的氮能夠進行此化學反應。奧默和施密茨在1964年錄得氮轉移的第一個實例。 [23]
Amination of N-nucleophiles[编辑]
以N-未取代氧氮雜環進行親核試劑的胺化,對親核試劑和相對應的產品來說是很常用的。Hydrazines可以從胺化的2級或3級胺產生,而羥胺和硫羥胺可以被相應的醇和硫醇產生,sulfimides可以從硫醚和α-氨基酮產生也可以由相應的烯醇化物的攻擊產生。[24]

N-acylamidation[编辑]
要轉移酰基化上的胺比未取代的胺困難,在轉移酰胺這方面,目前沒還有直接轉移的方法。[24]Acylamine主要是作為轉移親核試劑的胺和hydrazines。目前有少數論文表示,少數的酰基化的氮與碳親核試劑成功的進行。[24]

重排[编辑]
目前研究發現當氧氮雜環丙烷用紫外光照射或在單電子轉移之下會透過輻射機制重新排列,例如:cuspirocylic氧氮雜環丙烷進行環擴展到的內酰胺。[25]有趣的是,遷移取代基會受到立體電子效應影響,在氮上的孤對電子常常是最主要遷移的產物。[26] 在光的影響中,可以藉由下列的選擇性重組觀察到,掌性氮會受到反相阻隔並直接重排。 重組的過程中,左邊的熱力學產物是較不容易產生的,反應較喜愛從不穩定的自由基中間物產生右邊的產物。[25]

AUBE利用這種重組反應作為在合成(+)-yohimbine,[25]的關鍵步驟,(+)-yohimbine是一種天然藥物,NIH歸類為可以治療由選擇性血清素再吸收抑制劑所引起的勃起功能障礙性問題。

還有值得注意的是氧氮雜環丙烷有可能熱重組為硝酮(nitrones),且產量相當可觀,相反,利用順反選擇的nitrons的產物通常很少,品質也不好。目前認為一些氧氮雜環丙烷經過一段時間會轉變為硝酮中間產物。[5]

Cycloaddions with heterocumulenes[编辑]
氧氮雜環丙烷和heterocumulenes在環加成反應中,加入了獨特的五元雜環化合物如下圖所示。這反應是由於張力3元環和弱NO鍵產生。[5]

參考[编辑]
- ^ CID 15817734 - PubChem Public Chemical Database. The PubChem Project. USA: National Center for Biotechnology Information. [2013-07-11]. (原始内容存档于2012-11-03).
- ^ Emmons, W. D. J. Am. Chem. Soc. 1956, 78 (23): 6208. doi:10.1021/ja01604a072. 缺少或
|title=为空 (帮助) - ^ Krimm, H. Chem. Abstr. 1957, 256. 缺少或
|title=为空 (帮助) - ^ Horner, L.; Jürgens, E. Notiz Über Darstellung und Eigenschaften Einiger Isonitrone (Oxazirane). Chemische Berichte. 1957, 90 (10): 2184. doi:10.1002/cber.19570901010.
- ^ 5.0 5.1 5.2 5.3 5.4 Davis, F. A.; Sheppard, A. C. Applications of oxaziridines in organic synthesis. Tetrahedron. 1989, 45 (18): 5703. doi:10.1016/s0040-4020(01)89102-x.
- ^ Davis, F. A.; Stringer, O. D. Chemistry of oxaziridines. 2. Improved synthesis of 2-sulfonyloxaziridines. The Journal of Organic Chemistry. 1982, 47 (9): 1774. doi:10.1021/jo00348a039.
- ^ Davis, F. A.; Chattopadhyay, S.; Towson, J. C.; Lal, S.; Reddy, T. Chemistry of oxaziridines. 9. Synthesis of 2-sulfonyl- and 2-sulfamyloxaziridines using potassium peroxymonosulfate (oxone). The Journal of Organic Chemistry. 1988, 53 (9): 2087. doi:10.1021/jo00244a043.
- ^ 8.0 8.1 8.2 Davis, F. A.; Chen, B. C. Asymmetric hydroxylation of enolates with N-sulfonyloxaziridines. Chem. Rev. 1992, 92 (5): 919. doi:10.1021/cr00013a008.
- ^ Davis, F. A.; Jenkins, R. H.; Awad, S. B.; Stringer, O. D.; Watson, W. H.; Galloy, J. Chemistry of oxaziridines. 3. Asymmetric oxidation of organosulfur compounds using chiral 2-sulfonyloxaziridines. Journal of the American Chemical Society. 1982, 104 (20): 5412. doi:10.1021/ja00384a028.
- ^ Davis, F. A.; Reddy, R. T.; McCauley, J. P.; Przeslawski, R. M.; Harakal, M. E.; Carroll, P. J. Chemistry of oxaziridines. 15. Asymmetric oxidations using 3-substituted 1,2-benzisothiazole 1,1-dioxide oxides. The Journal of Organic Chemistry. 1991, 56 (2): 809. doi:10.1021/jo00002a056.
- ^ 11.0 11.1 Towson, J. C.; Weismiller, M. C.; Lal, S. G.; Sheppard, A. C.; Davis, F. A. Org. Synth. 1990, 69: 158. 缺少或
|title=为空 (帮助) - ^ Davis, F. A.; Towson, J. C.; Weismiller, M. C.; Lal, S.; Carroll, P. J. Chemistry of oxaziridines. 11. (Camphorylsulfonyl)oxaziridine: synthesis and properties. Journal of the American Chemical Society. 1988, 110 (25): 8477. doi:10.1021/ja00233a025.
- ^ Bach, R. D.; Coddens, B. A.; McDouall, J. J. W.; Schlegel, H. B.; Davis, F. A. The mechanism of oxygen transfer from an oxaziridine to a sulfide and a sulfoxide: a theoretical study. The Journal of Organic Chemistry. 1990, 55 (10): 3325. doi:10.1021/jo00297a062.
- ^ 14.0 14.1 Davis, F. A.; Kumar, A.; Chen, B. C. Chemistry of oxaziridines. 16. A short, highly enantioselective synthesis of the AB-ring segments of .gamma.-rhodomycionone and .alpha.-citromycinone using (+)-[(8,8-dimethoxycamphoryl)sulfonyl]oxaziridine. The Journal of Organic Chemistry. 1991, 56 (3): 1143. doi:10.1021/jo00003a042.
- ^ Davis, F. A.; Weismiller, M. C.; Lal, G. S.; Chen, B. C.; Przeslawski, R. M. (Camphorylsulfonyl)imine dianion in the synthesis of new optically pure (camphorylsulfonyl)oxaziridine derivatives. Tetrahedron Letters. 1989, 30 (13): 1613. doi:10.1016/s0040-4039(00)99534-0.
- ^ Chen, B. C.; Weismiller, M. C.; Davis, F. A.; Boschelli, D.; Empfield, J. R.; Smith, A. B. Enantioselective synthesis of (+)-kjellmanianone. Tetrahedron. 1991, 47 (2): 173–82. doi:10.1016/S0040-4020(01)80914-5.
- ^ 17.0 17.1 17.2 Petrov, V. A.; Resnati, G. Polyfluorinated Oxaziridines: Synthesis and Reactivity. Chemical Reviews. 1996, 96 (5): 1809. doi:10.1021/cr941146h.
- ^ Evans, D. A.; Morrissey, M. M.; Dorow, R. L. Asymmetric oxygenation of chiral imide enolates. A general approach to the synthesis of enantiomerically pure .alpha.-hydroxy carboxylic acid synthons. journal of the American Chemical Society. 1985, 107 (14): 4346. doi:10.1021/ja00300a054.
- ^ Dounay, Amy B.; Forsyth, Craig J. Abbreviated Synthesis of the C3−C14 (Substituted 1,7-Dioxaspiro[5.5]undec-3-ene) System of Okadaic Acid. Org. Lett. 1999, 1 (3): 451. doi:10.1021/ol9906615.
- ^ Malgesini, Beatrice; Forte, Barbara; Borghi, Daniela; Quartieri, Francesca; Gennari, Cesare; Papeo, Gianluca. A Straightforward Total Synthesis of (−)-Chaetominine. Chem. Eur. J. 2009, 15 (32): 7922. doi:10.1002/chem.200900793.
- ^ Bohé, Luis; Hanquet, Gilles; Lusinchi, Marie; Lusinchi, Xavier. The stereospecific synthesis of a new chiral oxaziridinium salt. Tetrahedron Letters. 1993, 34 (45): 7271. doi:10.1016/S0040-4039(00)79306-3.
- ^ Arnone, Alberto; Foletto, Stefania; Metrangolo, Pierangelo; Pregnolato, Massimo; Resnati, Giuseppe. Highly Enantiospecific Oxyfunctionalization of Nonactivated Hydrocarbon Sites by Perfluoro-cis-2-n-butyl-3-n-propyloxaziridine. Org. Lett. 1999, 1 (2): 281. doi:10.1021/ol990594e.
- ^ Schmitz, E.; Ohme, R. Isomere Oxime mit Dreiringstruktur. Chem. Ber. 1964, 97 (9): 2521. doi:10.1002/cber.19640970916.
- ^ 24.0 24.1 24.2 Andreae, S.; Schmitz, E. ChemInform Abstract: Electrophilic Aminations with Oxaziridines. ChemInform. 1991, 22 (46): 327. doi:10.1002/chin.199146339.
- ^ 25.0 25.1 Aubé, Jeffrey. Oxiziridine rearrangements in asymmetric synthesis. Chemical Society Reviews. 1997, 26 (4): 269. doi:10.1039/CS9972600269.
- ^ Lattes, Armand; Oliveros, Esther; Riviere, Monique; Belzeck, Czeslaw; Mostowicz, Danuta; Abramskj, Wojciech;Piccinni-Leopardi, Carla; Germain, Gabriel; Van Meerssche, Maurice. Photochemical and thermal rearrangement of oxaziridines. Experimental evidence in support of the stereoelectronic control theory. Journal of the American Chemical Society. 1982, 104 (14): 3929. doi:10.1021/ja00378a024.