苯酚
| 此條目需要精通或熟悉化学的编者参与及协助编辑。 (2020年6月26日) |
| 苯酚 | |||
|---|---|---|---|
| |||
| |||

| |||
| IUPAC名 Hydroxybenzene 羥基苯 | |||
| 别名 | 石炭酸 | ||
| 识别 | |||
| CAS号 | 108-95-2 | ||
| PubChem | 996 | ||
| ChemSpider | 971 | ||
| SMILES |
| ||
| InChI |
| ||
| ChEBI | 15882 | ||
| RTECS | SJ3325000 | ||
| DrugBank | DB03255 | ||
| KEGG | D06536 | ||
| 性质 | |||
| 化学式 | C6H5OH | ||
| 摩尔质量 | 94.11 g·mol⁻¹ | ||
| 外观 | 無色结晶状固体 | ||
| 密度 | 1.07 g/cm³ | ||
| 熔点 | 40.5 °C | ||
| 沸点 | 181.7 °C | ||
| 溶解性(水) | 8.3 g/100 ml (20 °C) | ||
| pKa | 9.95 | ||
| 偶极矩 | 1.7 D | ||
| 危险性 | |||
| 欧盟分类 | 有毒 (T) 突变原 腐蚀性 (C) | ||
| NFPA 704 | |||
| 闪点 | 79 °C | ||
| 相关物质 | |||
| 相关化学品 | 苯硫酚、苯硒酚、苯碲酚 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
苯酚(化学式:C
6H
5OH,PhOH),又名石炭酸、羟基苯,是最简单的酚类有机物,常温下为一种无色针状晶体。具毒性、弱酸性,易潮解。
苯酚是一种常见的化学品,是生产某些树脂、杀菌剂、防腐剂以及药物(如阿司匹林)的重要原料。
发现[编辑]
苯酚是由德国化学家荣格(Runge F)于1834年在煤焦油中发现的,故又称石炭酸(Carbolic acid)。
结构[编辑]
苯酚分子由一个羟基直接连在苯环上构成。根据苯的凯库勒式,这个羟基是连在双键上的,为烯醇式结构。但由于苯环的稳定性,这样的结构几乎不会转化为酮式结构。
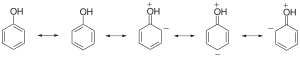
苯酚具有以下共振结构:
苯酚盐负离子则有以下共振结构:
酚羟基的氧原子采用sp2杂化,提供1对孤电子与苯环的6个碳原子共同形成离域 键。大Π键加强了烯醇的酸性,羟基的推电子效应又加强了O-H键的极性,因此苯酚中羟基的氢可以电离出来。
物理性质[编辑]
苯酚熔点为40.5℃,沸点为181.7℃,常温下为一种无色或白色的晶体,有特殊气味。苯酚密度比水大,微溶于冷水,可在水中形成白色混浊;但易溶于65℃以上的热水。易溶于醇、醚等有机溶剂。常温时苯酚含水27%可成为均匀液体。
化学性质[编辑]
- 酸碱反应
苯酚具有弱酸性,能与碱反应:
苯酚pKa=10,酸性介于碳酸两级电离之间,因此苯酚不能与碳酸氫鈉等弱碱反应:
此反应现象:二氧化碳通入后,溶液中出现白色混浊。
- 显色反应
苯酚遇三氯化铁溶液显紫色,原因是苯酚根离子与Fe3+形成了有颜色的配合物。
- (紫色)
- 取代反应


对比苯的相应反应可以发现,苯酚环上的取代比苯容易得多。这是因为羟基有给电子效应,使苯环电子云密度增加。
值得注意的是,苯酚的亲电取代总是发生在羟基的邻位和对位。这是羟基等给电子基团的共性。

- 氧化还原反应
苯酚在空气中久置会变为粉红色,是因为生成了苯醌:

- 缩合反应
苯酚与甲醛在酸或碱的催化下发生缩合,生成酚醛树脂。
制备[编辑]
- 熔融苯磺酸法

用酸处理即得苯酚。此法是最早用来制取苯酚的方法,萘酚也用类似的方法制取。
此法初始原料为苯,通过傅-克反应与丙烯加成为异丙苯,再由异丙苯氧化为苯酚。此法同时生成丙酮。
第二步反应是一个自由基反应。
- 氯苯水解
通过氯苯在氢氧化钠水溶液中的水解,也可以制得苯酚。由于氯苯的氯原子参与苯环的共轭,这个水解过程十分困难,需要在高压(28MPa)、高温(300℃)、以铜作催化剂的条件下进行。
- 其他方法

2007年吉林大学化学学院的冯守华等人在有机化学通讯期刊上发表文章称,他们用碳酸氢钠和铁粉在仿早期地球环境的条件下进行水热合成(水,200℃,1.9GPa),在产物中得到了产率为0.8%的苯酚。[1]

他们认为反应机理如下:[2]

安全[编辑]
苯酚有毒。苯酚及其浓溶液对皮肤有强烈的刺激作用,若不慎将苯酚沾到皮肤上,应用酒精或聚乙二醇清洗;若量较大或者混有氯仿,则需要进行急救。沾到衣服上也需用大量水冲洗。
工业及醫學用途[编辑]
苯酚可作杀菌剂、麻醉剂、防腐剂。英國外科醫生约瑟夫·李斯特(Lister J)於1865年将其用于外科手术消毒,為最早以藥劑進行術前消毒的醫生;但由于苯酚的毒性,这一技术最终被取代。现在苯酚可用于制备消毒剂,如TCP;或用其稀溶液直接进行消毒。
苯酚是多种化工产品的原料,用来合成阿司匹林等药品,以及一些农药、香料、染料。亦用来合成树脂,最主要的一种是和甲醛缩合而成的酚醛树脂。
尽管苯酚的浓溶液毒性很强,它仍在整形外科手术中充当脱皮剂。
衍生物[编辑]
参见[编辑]
註釋[编辑]
- ^ Tian, Ge; Yuan, Hongming; Mu, Ying; He, Chao; Feng, Shouhua. Hydrothermal Reactions from Sodium Hydrogen Carbonate to Phenol. Organic Letters. 2007-05, 9 (10): 2019–2021 [2020-11-05]. ISSN 1523-7060. doi:10.1021/ol070597o. (原始内容存档于2019-12-02) (英语).
- ^ Shouhua Feng, Ge Tian, Hongming Yuan, Ying Mu & Chao He. Supporting Information for Hydrothermal Reactions from Sodium Hydrogen Carbonate to Phenol (PDF). [2009-08-15]. (原始内容 (PDF)存档于2007-12-15).
参考文献[编辑]
- 邢其毅. 第十七章. 基础有机化学. 北京: 高等教育出版社. 1993 [2020-11-05]. ISBN 978-7-04-004276-4. OCLC 768503522. (原始内容存档于2020-12-18) (中文).
| |||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||
| ||||||||||||||||||||||
| ||||||||||||










![{\displaystyle {\rm {\ 6PhOH+FeCl_{3}\rightarrow H_{3}[Fe(OPh)_{6}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/046c2cd1dfbf511b14ae46217344394c8b98d953)



