霍纳-沃兹沃思-埃蒙斯反应
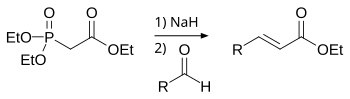
霍纳-沃兹沃思-埃蒙斯反应(英語:Horner–Wadsworth–Emmons reaction),簡稱HWE反應,常误称为维蒂希-霍纳反应,是制取烯烃的反应,维蒂希反应的改进。反应用稳定的膦酸酯碳负离子,代替磷叶立德,与醛、酮反应生成烯烃。产物主要为E-型烯烃。反应综述参见:[1][2][3][4]。
1958年列奥波德·霍纳在研究其他有机磷化合物改进的维蒂希反应时(主要是用氧化膦稳定的碳负离子),首先发表了用膦酸酯改进的维蒂希反应。[5][6]而后威廉·沃兹沃思与威廉·埃蒙斯对反应作了进一步的研究。[7][8]
一般参加反应的膦酸酯α-碳上需要连有吸电子基团(EWG),以使反应中的四元环中间体消除生成烯烃。反应的副产物O,O-二烷基磷酸盐可溶于水,很容易通过水溶液萃取而与生成的不饱和酸酯分离。
反应机理[编辑]
首先是膦酸酯α-碳的去质子化,生成碳负离子1。1与醛、酮2发生亲核加成,由于立体取向不同,可以生成两种产物3a及3b。这一步是决速步骤。[9]3a和3b中的氧负离子进攻磷原子,生成一个氧杂的四元环中间体(oxaphosphetane),即4a和4b。若取代基R2为氢,则中间体3a、4a与3b、4b形成平衡,可以互相转化(见假旋转)。[10] 最后4a与4b发生逆[2+2]环加成反应,消除生成E型烯烃5和Z型烯烃6。

反应生成的是烯烃的哪一个异构体(5与6),与碳负离子和醛酮加成时的方向有关,但也依靠反应的可逆性与两个中间体之间的相互转化。加成一步时,采取反叠构象,醛的氢原子尽量与较大的基团(如膦酸酯基)重叠,从而确保了下一步生成EWG与R3处于syn型的3a,消除得到E型烯烃。另一方面,也可以认为生成3a与3b的反应是可逆的,由于3b中两个较大的基团(R3与EWG)处于同侧,因此与3a相比较不易环化为四元环,会逐渐转化为较稳定的3a。最后一步消除是不可逆的,从而3a一旦生成,就会很快生成4a,并消除为E型的烯烃;3b则会重新转化为膦酸酯、3a,或直接转化为3a,并很快生成4a、5。中间体之间的平衡越充分,产物中E型烯烃的比例就越高。与维蒂希反应中的磷叶立德相比,膦酸酯形成的碳负离子的碱性和亲核性都更强。
原料膦酸酯可以很容易由亚磷酸酯与卤代烃发生米歇尔–阿尔布佐夫反应得到。若卤代烃为溴代乙酸酯,则生成的膦酸酯在α-碳连有吸电子基(如酯基),可以很顺利地发生消除生成烯。如果膦酸酯不含吸电子基团,反应的产物是α-羟基膦酸酯(3a、3b),[11] 用二异丙基碳二亚胺处理脱水也能转化为烯烃。[12]
立体选择性[编辑]
二取代烯烃[编辑]
汤普森和克莱顿·希斯考克在研究了(甲氧基羰基甲基)膦酸二甲酯与醛生成二取代烯烃的反应后,总结出以下使产物中E型烯烃比例增大的因素:[13]
三取代烯烃[编辑]
用α-双取代的膦酸酯与脂肪醛发生HWE反应时,三取代烯烃的构型与膦酸酯所含基团的体积大小和吸电子基团的性质有很大关系。见下面的例子。[14]
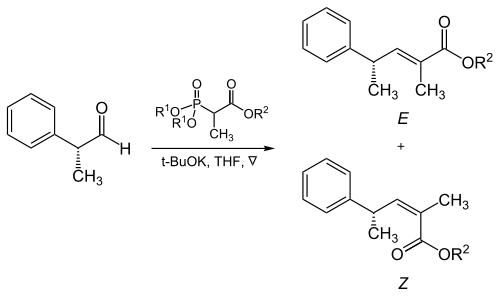
| R1 | R2 | 异构体比例 ( E : Z ) |
|---|---|---|
| 甲基 | 甲基 | 5 : 95 |
| 甲基 | 乙基 | 10 : 90 |
| 乙基 | 乙基 | 40 : 60 |
| 异丙基 | 乙基 | 90 : 10 |
| 异丙基 | 异丙基 | 95 : 5 |
改进[编辑]
碱[编辑]
很多官能团对反应中强碱性环境(如氢化钠)的耐受性不好。对此有很多改进方法,比如正宗悟和劳什的方法是用较为温和的氯化锂与DBU;[15]拉特克的方法是用锂或镁的卤化物与三乙胺的混合物,[16]等等。[17][18][19]
斯蒂尔改进[编辑]
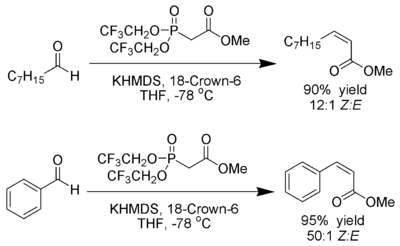
以四氢呋喃作溶剂,用强吸电子基(三氟乙基[20])取代的膦酸酯在强解离环境下(KHMDS与18-冠-6)反应,霍纳-沃兹沃思-埃蒙斯反应的立体化学特征逆转,生成以Z型烯烃为主的产物。这个方法称为斯蒂尔改进。[21]
维蒂希-霍纳反应[编辑]
维蒂希-霍纳反应是用氧化膦稳定的碳负离子与醛加成,生成β-羟基氧化膦,而后与碱作用,消除生成烯烃的反应。一般生成的β-羟基氧化膦都为非对映异构体的混合物。如果可以将中间产物羟基氧化膦分离,拆分为两个非对映异构体,并分别与碱在高温下消除,则可以立体专一地生成烯烃的两个异构体。erythro生成Z型烯烃,threo生成E型烯烃。或者也可先酰基化,再用硼氢化钠和三氯化铈还原。

机理:

参见[编辑]
参考资料[编辑]
- ^ Wadsworth, W. S., Jr. Org. React. 1977, 25, 73-253.(综述)
- ^ Boutagy, J.; Thomas, R. Chem. Rev. 1974, 74, 87-99. doi:10.1021/cr60287a005.(综述)
- ^ Kelly, S. E. Comp. Org. Syn. 1991, 1, 729-817.(综述)
- ^ B. E. Maryanoff; Reitz, A. B. Chem. Rev. 1989, 89, 863-927. doi:10.1021/cr00094a007.(综述)
- ^ Leopold Horner; Hoffmann, H. M. R.; Wippel, H. G. Ber. 1958, 91, 61-63.
- ^ Horner, L.; Hoffmann, H. M. R.; Wippel, H. G.; Klahre, G. Ber. 1959, 92, 2499-2505.
- ^ Wadsworth, W. S., Jr.; Emmons, W. D. J. Am. Chem. Soc. 1961, 83, 1733. doi:10.1021/ja01468a042.
- ^ Wadsworth, W. S., Jr.; Emmons, W. D. Organic Syntheses, Coll. Vol. 5, p.547 (1973); Vol. 45, p.44 (1965). 链接 (页面存档备份,存于互联网档案馆).
- ^ Larsen, R. O.; Aksnes, G. Phosphorus Sulfur 1983, 15, 218-219.
- ^ Lefèbvre, G.; Seyden-Penne, J. J. Chem Soc., Chem. Commun. 1970, 1308-1309.
- ^ Corey, E. J.; Kwiatkowski, G. T. J. Am. Chem. Soc. 1966, 88, 5654-5656. doi:10.1021/ja00975a057.
- ^ Reichwein, J. F.; Pagenkopf, B. L. J. Am. Chem. Soc. 2003, 125, 1821-1824. doi:10.1021/ja027658s.
- ^ Thompson, S. K.; Heathcock, C. H. J. Org. Chem. 1990, 55, 3386-3388. doi:10.1021/jo00297a076.
- ^ Nagaoka, H.; Kishi, Y. Tetrahedron 1981, 37, 3873-3888.
- ^ Blanchette, M. A.; Choy, W.; Davis, J. T.; Essenfeld, A. P.; Masamune, S.; Roush, W. R.; Sakai, T. Tetrahedron Lett. 1984, 25, 2183-2186.
- ^ Rathke, M. W.; Nowak, M. J. Org. Chem. 1985, 50, 2624-2626. doi:10.1021/jo00215a004.
- ^ Paterson, I.; Yeung, K.-S.; Smaill, J. B. Synlett 1993, 774.
- ^ Simoni, D.; Rossi, M.; Rondanin, R.; Mazzali, A.; Baruchello, R.; Malagutti, C.; Roberti, M.; Invidiata, F. P. Org. Lett. 2000, 2, 3765-3768.
- ^ Blasdel, L. K.; Myers, A. G. Org. Lett. 2005, 7, 4281-4283.
- ^ Patois, C.; Savignac, P.; About-Jaudet, E.; Collignon, N. Organic Syntheses, Coll. Vol. 9, p.88 (1998); Vol. 73, p.152 (1996). 链接 (页面存档备份,存于互联网档案馆).
- ^ Still, W. C.; Gennari, C. Tetrahedron Lett. 1983, 24, 4405-4408.
外部链接[编辑]
- Horner-Wadsworth-Emmons反应(页面存档备份,存于互联网档案馆) 于organic-chemistry.org.
- Horner-Wadsworth-Emmons反应 于威斯康星大学麦迪逊分校网站.
- 用有机硅/硫/磷化合物为原料的烯烃合成反应(页面存档备份,存于互联网档案馆).
