氟锑酸
| 氟锑酸 | |
|---|---|

| |

| |
| IUPAC名 Fluoroantimonic acid | |
| 系统名 Hydrogen hexafluoro-λ5-stibanuide | |
| 别名 | 六氟锑酸 六氟合锑(V)酸 |
| 识别 | |
| CAS号 | 16950-06-4(无水) 72121-43-8(六水) |
| PubChem | 6337100 |
| ChemSpider | 21241496 |
| SMILES |
|
| EINECS | 241-023-8 |
| 性质 | |
| 化学式 | HSbF6 |
| 摩尔质量 | 236.808(无水) 344.85(六水) g·mol⁻¹ |
| 外观 | 无色液体(无水物) 无色固体(六水合物)[1] |
| 密度 | 2.885 g/cm3(25℃,无水) |
| 沸点 | 分解 |
| 溶解性(水) | 分解 |
| 溶解性 | 溶于SO2ClF,SO2 |
| pKa | −25 |
| pKb | 39 |
| 危险性 | |
| 欧盟危险性符号 | |
| 警示术语 | R:R39/23/24/25, R35 |
| 安全术语 | S:S1/2, S36/37/39, S45, S53, S60, S61 |
| 主要危害 | 强腐蚀性,剧烈水解 |
| NFPA 704 | |
| 闪点 | 不可燃 |
| 相关物质 | |
| 其他阴离子 | HPF6、HAsF6 |
| 其他阳离子 | NaPF6、NaSbF6 |
| 相关化学品 | HF、SbF5 魔酸 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
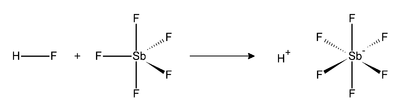
氟锑酸(化学式:HSbF6)或称六氟锑酸,是氢氟酸和五氟化锑反应后的产物。[2]以一比一的比例混合时成为现在已知最强的超强酸,实验证明能分解碳氢化合物,产生碳正离子以及氢气。[3]
氢氟酸(HF)和五氟化锑(SbF5)反应强烈放热。HF会释放质子H+,然后氟离子F−会与SbF5形成八面体型的SbF6−阴离子。SbF6−是非配位阴离子,亲核性和碱性都很弱。于是质子实际上是“裸露”在溶液中,使得混合物体系呈现极强的酸性,比纯硫酸要强2×1019倍,以下是氢氟酸和五氟化锑的反应方程式:
结构[编辑]
用X射线晶体学研究两份反应形成的结晶,发现化学式分别为和,都含有Sb2F11−作阴离子。[4]据估计,Sb2F11−离子的碱性比SbF6−还要弱,因此更加稳定。
与其他酸的对照[编辑]
以下的资料是以哈米特酸度函数作为依据,酸度以大负数H0值表示:
- 氟锑酸 (1990) (H0值 = −31.3)
- 魔酸 (1974) (H0值 = −19.2)
- 碳硼烷酸 (1969) (H0值 = −18.0)
- 氟磺酸 (1944) (H0值 = −15.1)
- 三氟甲磺酸 (1940) (H0值 = −14.9)
反应[编辑]
氟锑酸加热到40 °C下分解,生成氟化氢气体和五氟化锑液体。[5]
应用[编辑]
氟锑酸使其几乎可以质子化所有的有机化合物。它与异丁烷和新戊烷反应会生成相应的碳正离子:[6][7]
危险性[编辑]
氟锑酸会与水起强烈甚至爆炸性的反应,而且它会与目前已知几乎所有的溶剂发生反应。[2]能溶解氟锑酸的溶剂有磺酰氟氯(SO2ClF)、液态二氧化硫及氟氯烃。盛的容器可用特氟龙制造。
参考文献[编辑]
- ^ 氟锑酸MSDS. SigmaAldrich
- ^ 2.0 2.1 Olah, G. A.; Prakash, G. K. S.; Wang, Q.; Li, X. “Hydrogen Fluoride–Antimony(V) Fluoride” in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI: 10.1002/047084289.
- ^ George Andrew Olah. A life of magic chemistry: autobiographical reflections of a nobel prize winner. John Wiley and Sons. 2001: 100–101. ISBN 0471157430.
- ^ Mootz, D.; Bartmann, K. The Fluoronium Ions H2F+ and H3F2+: Characterization by Crystal Structure Analysis. Angewandte Chemie, International Edition in English. 1988, 27: 391–392. doi:10.1002/anie.198803911.
- ^ Oelderik, Jan. Werkwijze ter bereiding van halogeenverbindingen van vijfwaardig antimoon. Netherlands Patent Application. December 1966,. NL 6508096 A.
- ^ Bickel, A. F.; Gaasbeek, C. J.; Hogeveen, H.; Oelderik, J. M.; Platteeuw, J. C. Chemistry and spectroscopy in strongly acidic solutions: reversible reaction between aliphatic carbonium ions and hydrogen. Chemical Communications. 1967, 1967: 634–5. doi:10.1039/C19670000634.
- ^ Hogeveen, H.; Bickel, A. F. Chemistry and spectroscopy in strongly acidic solutions: electrophilic substitution at alkane-carbon by protons. Chemical Communications. 1967, 1967: 635–6. doi:10.1039/C19670000635.
参见[编辑]
- 影片:氟锑酸 vs iPhone7 (页面存档备份,存于互联网档案馆)(英文). Game Freak from Youtube
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||






![{\displaystyle {\ce {[H2F+][{Sb2F11}^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1f6e455246bc6ba24c670635011b126a9eb07538)
![{\displaystyle {\ce {[{H3F2}^{+}][{Sb2F11}^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f6ddf643e74cf87a50dcb03a4478f98380fb7d32)

