贝里斯-希尔曼反应
(重定向自贝里斯-希尔曼反应)
贝里斯-希尔曼反应(Baylis–Hillman reaction),是α,β-不饱和化合物与亲电试剂(醛、酮)在合适的催化剂作用下,生成烯烃α-位加成产物的反应。催化剂一般采用DABCO(1,4-二氮杂双环[2,2,2]辛烷的缩写形式,俗称:三亚乙基二胺),生成物为烯丙基醇[1]。这一反应又被称为森田-贝里斯-希尔曼反应(Morita–Baylis–Hillman reaction),或者简称为MBH反应(MBH reaction)[2],这一反应名称得名自日本化学家森田健一(Ken-ichi Morita)、英国化学家安东尼·贝里斯(Anthony B. Baylis)和德国化学家梅维尔·希尔曼(Melville E. D. Hillman)。
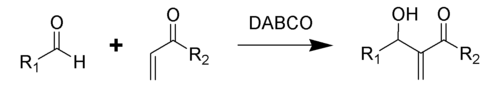
后来,亲电试剂扩展到亚胺类sp2型碳的亲电试剂,称为氮杂-贝里斯-希尔曼反应[3]。
反应底物中的亲电试剂可以是醛、亚胺、亚胺盐以及活化的酮。α,β-不饱和化合物(活化烯烃)可以是丙烯酸酯、丙烯醛、乙烯基酮、丙烯腈、α,β-不饱和砜、亚砜、亚胺以及α,β-不饱和环烯酮等缺电子烯烃。
除DABCO可作为催化剂外,其他的叔胺和叔膦乃至硒酚锂等弱亲核试剂也可以用于催化这个反应[4][5]。
反应机理[编辑]
贝里斯-希尔曼反应经历叔胺与活化烯烃的Michael加成反应启动的加成-消除反应历程[6]。

反应特点[编辑]
- 反应原料廉价,比较易得。
- 反应具有原子经济性。
- 反应产物具有多个可以进一步反应,进行继续转化的官能团。
- 环境友好,反应用到的催化剂主要是有机小分子催化剂,从而可以避免通常情况下,不对称催化反应中可能用到的金属离子。
- 反应条件温和,多数反应在室温条件下就可以进行。
应用[编辑]
参见[编辑]
参考资料[编辑]
- ^ Baylis, A. B.; Hillman, M. E. D. German Patent. 1972. 缺少或
|title=为空 (帮助) 2,155,113. - ^ Morita, K.; Z. Suzuki, H. Hirose. Bull. Chem. Soc. Jpn. 1968, 41 (2815). 缺少或
|title=为空 (帮助) - ^ Perlmutter, P.; Teo, C. C. Tetrahedron Lett. 1984, 25 (5951). 缺少或
|title=为空 (帮助) - ^ Basavaiah, D.; Rao, P. D.; Hyma, R. S. Tetrahedron. 1996, 52: 8001. 缺少或
|title=为空 (帮助)(综述) - ^ Ciganek, E. Org. React. 1997, 51 (201). 缺少或
|title=为空 (帮助)(综述) - ^ Hill, J. S.; Isaacs, N. S. J. Phys. Org. Chem. 1990, 3 (285). 缺少或
|title=为空 (帮助) - ^ Iwabuchi, Y.; Nakatani, M.; Yokoyama, N.; Hatakeyama, S. J. Am. Chem. Soc. 1999, 121 (10219). 缺少或
|title=为空 (帮助) - ^ Iura, Y.; Sugahara, T.; Ogasawara, K. Org. Lett. 2001, 3 (291). 缺少或
|title=为空 (帮助) - ^ Shi, M.; Xu, Y.-M. Angew. Chem. Int. Ed. 2002, 41 (4507). 缺少或
|title=为空 (帮助)
