β摺疊
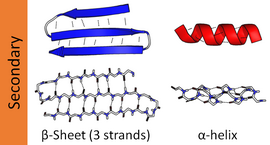


β摺疊(β-sheet),又稱β片層結構(β-pleated sheet),是蛋白質的一種二級結構。
在β摺疊中,兩條以上氨基酸鏈(肽鏈),或同一條肽鏈之間的不同部分形成平行或反平行排列,成為「股」。肽平面之間呈手風琴狀摺疊,股與股之間會通過氫鍵固定,但氫鍵主要在股間而不是股內。氨基酸殘基的R側鏈分布在片層的上下。
β摺疊層並不是平的,因為側鏈的存在使得它看上去像手風琴一樣波紋起伏。(英語pleated)這樣每一股會更緊密排列,氫鍵更容易建立。氫鍵的距離為7埃。在蛋白質結構中β摺疊通常會用箭頭表示。肽鏈的氮端在同側為順式,兩殘基間距為0.65nm;不在同側為反式,兩殘基間距為0.70nm。反式較順式平行摺疊更加穩定。
能形成β摺疊的氨基酸殘基一般不大,而且不帶同種電荷,這樣有利於多肽鏈的伸展,如甘氨酸、丙氨酸在β摺疊中出現的幾率最高。免疫球蛋白有大量的β摺疊層。
另一種常見的蛋白質模序是α螺旋和三種不同的β轉角。不屬於一個模序的蛋白質一級結構部分被稱之為不規則螺旋。這些部分對蛋白質的空間構象非常重要。
延伸閲讀[編輯]
- Cooper J. Super Secondary Structure - Part II. Principles of Protein Structure Using the Internet. 31 May 1996 [25 May 2007]. (原始內容存檔於2016-12-28).
- Open-sided Beta-meander. Structural Classification of Proteins (SCOP). 20 October 2006 [31 May 2007]. (原始內容存檔於2012-02-04).
參見[編輯]
外部連結[編輯]
- (英文)Anatomy & Taxonomy of Protein Structures -survey (頁面存檔備份,存於網際網路檔案館)
- (英文)NetSurfP - Secondary Structure and Surface Accessibility predictor (頁面存檔備份,存於網際網路檔案館)
- (英文)Interactive model of an anti-parallel β sheet (plug-in required)
- (英文)Interactive model of a parallel β sheet (plug-in required)
- (英文)Animated details of β-pleated sheet[永久失效連結]
- (英文)Monooxygenase (頁面存檔備份,存於網際網路檔案館)
- 精美的蛋白質二級結構圖示
| ||||||||||||||||||||||||||||||||||||||||||||||
