酰胺




酰胺在自然界中廣泛存在,並在科學技術中有重要應用。蛋白質中的肽鍵便以酰胺結構相連接。工業上重要的化工材料,如尼龍、芳綸、克維拉、特瓦綸等都是含酰胺結構單體聚合成的合成纖維。許多藥物也都包含酰胺結構,它幫助維持剛性結構並抵抗水解,如對乙酰氨基酚、青黴素、LSD等[3]。一些低分子量的酰胺,是常用的有機溶劑,如DMF和DMAc。
命名[編輯]
酰胺可以看作羧酸被氨基或胺取代後衍生的產物,因此可以將酸字改為酰胺來命名,英文命名時將-ic acid改為-amide[4],例如:
 |
 |

|
| 乙酰胺 | 異丁(基)酰胺 | 乙二酰二胺 |
當酰胺中的氮上連有多個烴基時,則需要將氮上取代基寫在某酰之前,並用N-來表示其位置(在沒有歧義時可省略),例如:
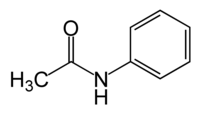 |
 |
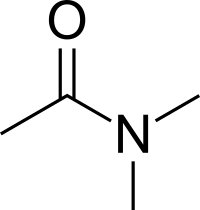
|
| 乙酰苯胺 | N,N-二甲基甲酰胺 | 二甲基乙酰胺 |
二元羧酸被氨(或胺)基取代時,稱為「某二酰胺」,英文命名時將詞尾-dioic acid改為-diamide;當兩個羧基被同一個氨(或胺)基取代得到環狀化合物時,稱為「某二酰亞胺」,英文命名時將詞尾改為-imide;當胺上的烴基與酰胺的碳原子首尾相連形成環狀化合物時,稱為「某內酰胺」,英文命名時將詞尾改為-lactam[5],例如:
 |
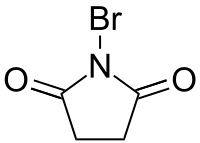 |

|
| 丁二酰胺 | N-溴代丁二酰亞胺 | 4-丁內酰胺 |
酰胺根據其N上取代程度,可分為伯(一級)酰胺、仲(二級)酰胺和叔(三級)酰胺[6]。
結構[編輯]

酰胺中的C-N鍵較胺中的C-N鍵要短,一方面是因為酰胺中C-N鍵的碳是用sp2雜化軌道與氮成鍵,而胺中C-N鍵的碳是用sp3雜化軌道與氮成鍵,s成分較少[7];另一方面是因為氮上孤對電子在羰基上離域,在碳、氮和氧間形成共軛體系,從而使C-N鍵具有某些雙鍵性質。因此,酰胺中的N、O、C位於同一平面,限制了圍繞酰基的旋轉[8][9]。
酰胺結構有以下的共振式:
性質[編輯]
除甲酰胺外,大部分具有RCONH2結構的酰胺為白色固體,這是因為分子間形成了氫鍵[10][11]。在羧酸衍生物中,酰胺具有最強的穩定性,其水解最難發生,一般需要在強酸性或鹼性條件下回流。相較於胺類,酰胺表現出較弱的鹼性,低級的酰胺可溶於水,例如DMF和DMAc便是很好的非質子極性溶劑,且可以與水混溶[10]。能與酸反應成鹽,其質子化發生在氧原子上,酰胺的鹼性要弱於胺,但強於酯、酮和羧酸,酰亞胺上的氫原子有弱酸性[12][13]。
蛋白質和肽是含有酰胺鍵的重要生物分子。一些生物鹼中也含有酰胺結構[14]。
合成[編輯]
酰胺可以通過羧酸與胺偶聯製備,直接反應需要高溫將水趕出體系[15]:

酰胺可以通過酯、酸酐(盧米埃爾-巴比耶方法)或酰氯(肖滕-鮑曼反應)與胺反應來合成。多肽合成中通過偶聯劑(如HATU、HOBt、PyBOP)來合成酰胺[16]。一些試劑,如Sheppard酰胺化試劑,被用來構建酰胺和亞胺結構[17][18]。
| 反應 | 底物 | 備註 |
|---|---|---|
| 親核酰基取代反應 | 酰氯或酸酐 | 試劑:氨或胺 |
| Beckmann重排 | 環酮 | 試劑:肟和酸催化 |
| Schmidt反應 | 酮 | 試劑:疊氮酸 |
| 腈的控制水解[19] | 腈 | 試劑:水和酸催化 |
| Willgerodt–Kindle反應 [20] | 芳基烷基酮 | 硫和嗎啉 |
| Passerini反應 | 異腈、酮(或醛)和羧酸 | 極性溶劑(如水或甲醇) |
| Ugi反應 | 異腈、羧酸、伯胺和酮(或醛) | |
| Bodroux反應[21][22] | 羧酸和格氏試劑的胺類衍生物(如IMgNHR) | 
|
| Chapman重排[23][24] | 芳基亞胺基醚 | 對N,N-二芳基亞胺,反應機理為分子內芳香族親核取代反應[25]  |
| Ritter反應[26] | 腈、烷基化試劑如(異丁烯、叔丁醇)和強酸。 | 在濃酸作用下,腈與碳正離子發生加成反應得到仲酰胺,Ritter反應能在叔碳處構建一根C-N鍵。 |
| 末端烯烴的光化學加成[27] | 末端烯烴和甲酰胺 | 甲酰胺對末端單烯烴的自由基同系化反應,得到反馬氏加成產物。 |
| 羧酸衍生物的氨解[28][29][30][31] | 酯、酰鹵、酰胺和酸酐 | 羧酸衍生物可以與氨反應,形成酰胺,稱為氨解。 |
其他反應[編輯]
有機釕化合物催化胺的脫氫酰化,該反應通過醇脫氫產生的醛,與胺形成半胺醛,隨後二次脫氫得到酰胺,該反應的副產物為氫氣[32] :
酰胺與胺反應生成新的酰胺的反應稱為酰胺交換反應,該反應進行地非常緩慢,需要路易斯酸 [33]和有機金屬催化劑[34]催化:
- RC(O)NR'2 + HNR"2 → RC(O)NR"2 + HNR'2
反應[編輯]

酰胺的酸性水解機理[35] 
酰胺的酸性與鹼性水解
酰胺會發生與酯相似的反應,但其反應性弱於酯。酰胺在熱鹼或強酸條件下會發生水解,酸性水解會產生對應羧酸和銨離子,鹼性水解會產生對應胺和羧酸根離子。由於酰胺的水解條件相較於酯、酰鹵更強烈,因此該反應不需要催化,也不可逆。
| 反應 | 產物 | 反應條件 |
|---|---|---|
| 脫水 | 腈 | P2O5; 苯磺酰氯; TFAA+py[36] |
| 霍夫曼重排 | 少一個碳原子的伯胺 | 溴+氫氧化鈉 |
| 還原[37] | 胺和醛 | i) LAH ii) H+/H2O |
| Vilsmeier–Haack反應 | 醛 | POCl3,芳香族底物 |
| Bischler–Napieralski反應 | 環亞胺 | POCl3,SOCl2等 |
參見[編輯]
參閱書籍[編輯]
- 邢其毅等. 《基础有机化学》第三版 上册. 高等教育出版社. 2005a.
- 邢其毅等. 《基础有机化学》第三版 下册. 高等教育出版社. 2005b.
參考文獻[編輯]
- ^ 國際純化學和應用化學聯合會,化學術語概略,第二版。(金皮書)(1997)。在線校正版: (2006–) "amides"。doi:10.1351/goldbook.A00266
- ^ Chapter 21: Amides and Imides. Nomenclature of Organic Compounds. Advances in Chemistry 126 (Washington, American Chemical Society). 1974: 166–173. ISBN 9780841201910. doi:10.1021/ba-1974-0126.ch021.
- ^ Boonen, Jente; Bronselaer, Antoon; Nielandt, Joachim; Veryser, Lieselotte; De Tré, Guy; De Spiegeleer, Bart. Alkamid database: Chemistry, occurrence and functionality of plant N-alkylamides (PDF). Journal of Ethnopharmacology. 2012, 142 (3): 563–590 [2022-07-12]. PMID 22659196. doi:10.1016/j.jep.2012.05.038. hdl:1854/LU-2133714
 . (原始內容 (PDF)存檔於2022-07-14).
. (原始內容 (PDF)存檔於2022-07-14).
- ^ 邢其毅等 2005a,第69-70頁.
- ^ 邢其毅等 2005a,第70頁.
- ^ Organic Chemistry IUPAC Nomenclature. Rules C-821. Amides http://www.acdlabs.com/iupac/nomenclature/79/r79_540.htm 網際網路檔案館的存檔,存檔日期21 January 2011.
- ^ 邢其毅等 2005b,第599頁.
- ^ Ivana Antol; Mirjana Eckert-Maksic; Hans Lischka. Ab Initio MR-CISD Study of Gas-Phase Basicity of Formamide in the First Excited Singlet State. The Journal of Physical Chemistry A. 2004, 108 (46): 10317–10325. doi:10.1021/jp048087o.
- ^ Yuko Otani; Osamu Nagae; Yuji Naruse; Satoshi Inagaki; Masashi Ohno; Kentaro Yamaguchi; Gaku Yamamoto; Masanobu Uchiyama; Tomohiko Ohwada. An Evaluation of Amide Group Planarity in 7-Azabicyclo[2.2.1]heptane Amides. Low Amide Bond Rotation Barrier in Solution. J. Am. Chem. Soc. 2003, 125 (49): 15191–15199. doi:10.1021/ja036644z.
- ^ 10.0 10.1 邢其毅等 2005b,第600頁.
- ^ Sayan Bagchi; Yung Sam Kim; Adam K. Charnley; Amos B. Smith; Robin M. Hochstrasser. Two-Dimensional Infrared Investigation of N-Acetyl Tryptophan Methyl Amide in Solution. The Journal of Physical Chemistry B. 2007, 111 (11): 3010–3018. doi:10.1021/jp067348m.
- ^ 邢其毅等 2005b,第623-624頁.
- ^ A. R. Goldfarb; A. Mele; N. Gutstein. Basicity of the Amide Bond. J. Am. Chem. Soc. 1955, 77 (23): 6194–6196. doi:10.1021/ja01628a031.
- ^ Yang Han; Tao Hou; Zi-Hui Zhang; Yao-Dong Wang; Jun-Xiang Cheng; Han Zhou; Ji-Xia Wang; Jia-Tao Feng; Yan-Fang Liu; Zhi-Mou Guo; Xin-Miao Liang. Structurally diverse isoquinoline and amide alkaloids with dopamine D2 receptor antagonism from Corydalis bungeana. Fitoterapia. 2022, 159: 105175. ISSN 0367-326X. doi:10.1016/j.fitote.2022.105175.
- ^ Montalbetti, Christian A. G. N.; Falque, Virginie. Amide bond formation and peptide coupling. Tetrahedron. 14 November 2005, 61 (46): 10827–10852. doi:10.1016/j.tet.2005.08.031.
- ^ Valeur, Eric; Bradley, Mark. Amide bond formation: beyond the myth of coupling reagents. Chem. Soc. Rev. 2009, 38 (2): 606–631. PMID 19169468. S2CID 14950926. doi:10.1039/B701677H.
- ^ Tris(2,2,2-trifluoroethyl) borate 97% | Sigma-Aldrich. www.sigmaaldrich.com. [2016-09-22].
- ^ Sabatini, Marco T.; Boulton, Lee T.; Sheppard, Tom D. Borate esters: Simple catalysts for the sustainable synthesis of complex amides. Science Advances. 2017-09-01, 3 (9): e1701028. Bibcode:2017SciA....3E1028S. PMC 5609808
 . PMID 28948222. doi:10.1126/sciadv.1701028.
. PMID 28948222. doi:10.1126/sciadv.1701028.
- ^ Wenner, Wilhelm. Phenylacetamide. Organic Syntheses. 1952, 32: 92. doi:10.15227/orgsyn.032.0092.
- ^ Karl Kindler. Studien über den Mechanismus chemischer Reaktionen. Erste Abhandlung. Reduktion von Amiden und Oxydation von Aminen. Liebigs Annalen. 1923, 431 (1): 187–230. doi:10.1002/jlac.19234310111.
- ^ Bodroux F. Bull. Soc. Chim. France. 1905, 33: 831.
- ^ Bodroux reaction. Institute of Chemistry, Skopje, Macedonia. [23 May 2007]. (原始內容存檔於24 September 2015).
- ^ Schulenberg, J. W.; Archer, S. The Chapman Rearrangement 14. 1965: 1–51. ISBN 978-0471264187. doi:10.1002/0471264180.or014.01.
- ^ Chapman, Arthur William. CCLXIX.—Imino-aryl ethers. Part III. The molecular rearrangement of N-phenylbenziminophenyl ether. Journal of the Chemical Society, Transactions. 1925, 127: 1992–1998. doi:10.1039/CT9252701992.
- ^ March, Jerry. Advanced organic Chemistry, Reactions, mechanisms and structure 3rd. 1966. ISBN 978-0-471-85472-2.
- ^ Adams, Rodger; Krimen, L.I.; Cota, Donald J. Organic Reaction Volume 17. London: John Wiley & Sons, Inc. 1969: 213–326. ISBN 9780471196150. doi:10.1002/0471264180.
- ^ Monson, Richard. Advanced Organic Synthesis: Methods and Techniques (PDF). New York: Academic Press. 1971: 141 [2022-07-26]. ISBN 978-0124336803. (原始內容 (PDF)存檔於2021-11-04).
- ^ Corson, B. B.; Scott, R. W.; Vose, C. E. Cyanoacetamide. Organic Syntheses. 1941, 1: 179. doi:10.15227/orgsyn.009.0036.
- ^ Jacobs, W. A. Chloroacetamide. Organic Syntheses. 1941, 1: 153. doi:10.15227/orgsyn.007.0016.
- ^ Kleinberg, J.; Audrieth, L. F. Lactamide. Organic Syntheses. 1955, 3: 516. doi:10.15227/orgsyn.021.0071.
- ^ 邢其毅等 2005b,第612-614頁.
- ^ Gunanathan, C.; Ben-David, Y.; Milstein, D. Direct Synthesis of Amides from Alcohols and Amines with Liberation of H2. Science. 2007, 317 (5839): 790–2. Bibcode:2007Sci...317..790G. PMID 17690291. S2CID 43671648. doi:10.1126/science.1145295.
- ^ T. A. Dineen; M. A. Zajac; A. G. Myers. Efficient Transamidation of Primary Carboxamides by in situ Activation with N,N-Dialkylformamide Dimethyl Acetals. J. Am. Chem. Soc. 2006, 128 (50): 16406–16409. PMID 17165798. doi:10.1021/ja066728i.
- ^ Emma L. Baker; Michael M. Yamano; Yujing Zhou; Sarah M. Anthony; Neil K. Garg. A two-step approach to achieve secondary amide transamidation enabled by nickel catalysis. Nature Communications. 2016, 7: 11554. Bibcode:2016NatCo...711554B. PMC 4876455
 . PMID 27199089. doi:10.1038/ncomms11554.
. PMID 27199089. doi:10.1038/ncomms11554.
- ^ Smith, Michael B.; March, Jerry, Advanced Organic Chemistry: Reactions, Mechanisms, and Structure 6th, New York: Wiley-Interscience, 2007, ISBN 978-0-471-72091-1
- ^ 美國專利第5,935,953號
- ^ 邢其毅等 2005b,第618-620頁.
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|





