三中心四電子鍵
三中心四電子鍵是用來解釋超價分子中成鍵情況的一種模型,這些分子包括五氟化磷、六氟化硫、氟化氙以及氟化氫根離子。[1][2] 也被叫做Pimentel-Rundle三中心模型,因為早在1951年,喬治·皮門特爾就發表了相關研究,[3]而該研究是建立在Robert E. Rundle對於缺電子成鍵研究上的。[4]
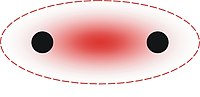
這個模型主要研究三個成直線原子間的成鍵,例如XeF2中的成鍵情況。該模型使用了三個並排成直線原子軌道來描述直線型的F-Xe-F分子。Xe-F鍵是由中心原子(Xe)的全滿p軌道和軸向原子(F)的兩個半滿軌道組合而成,包括一個全滿的成鍵軌道,一個全滿的非鍵軌道和一個空的反鍵軌道。HOMO主要集中在兩個端基原子上,對應的現象是在超價分子中端基原子的電負性都很大。其他更複雜的分子,例如PF5和SF4,則相當於採取了一個三中心四電子鍵外加三個(PF5)或兩個(SF4)其他的已知鍵。而SF6中所有鍵均用三中心四電子鍵來解釋。


在這種表述方式中,八隅體規則沒有被破壞,每個鍵的鍵級為1/2,同樣也符合氟原子周圍電荷密度增高的試驗現象。這種解釋和以上通過分子軌道理論的解釋基本一致。
在一些描述超價鍵的比較舊的理論中,一般引用到d軌道。儘管直到2008年,一些初學者層次的大學課本仍然會出現這些理論,但是根據量子化學的計算,因為p軌道(全滿)和d軌道(空)之間的能量差別太大,所以d軌道參與程度幾乎可以忽略不計。另外需要了解的是,談論共價鍵時所討論的「d軌道」和進行量子化學計算時用到的「d方程」並不是完全相同的。三中心四電子鍵的理論的優點就是免去了對d軌道的描述,這也是人們接受該理論的原因。[5]
參考資料[編輯]
- ^ Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd Edition. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4. p. 897.
- ^ Weinhold, F.; Landis, C. Valency and bonding, Cambridge, 2005; pp. 275-306.
- ^ Pimentel, G. C. The Bonding of Trihalide and Bifluoride Ions by the Molecular Orbital Method. J. Chem. Phys. 1951, 19, 446-448. doi:10.1063/1.1748245
- ^ Rundle, R. E. Electron Deficient Compounds. II. Relative Energies of "Half-Bonds". J. Chem. Phys 1949, 17, 671-675.doi:10.1063/1.1747367
- ^ Ramsden, C. A. Non-bonding molecular orbitals and the chemistry of non-classical organic molecules. Chem. Soc. Rev. 1994, 111-118.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||