二氯化二硫
| 二氯化二硫 | |
|---|---|
| |

| |

| |
| IUPAC名 Disulfur dichloride | |
| 系統名 Dichlorodisulfane 二氯二硫烷 | |
| 別名 | 一氯化硫 氯化硫 |
| 識別 | |
| CAS號 | 10025-67-9 85408-26-0(異丁烯構型) |
| PubChem | 24807 |
| ChemSpider | 23192, 19158348 (異丁烯構型) |
| SMILES |
|
| InChI |
|
| InChIKey | PXJJSXABGXMUSU-UHFFFAOYAK |
| UN編號 | 3390 |
| EINECS | 233-036-2 |
| RTECS | WS4300000 |
| MeSH | Sulfur+monochloride |
| 性質 | |
| 化學式 | S2Cl2 |
| 摩爾質量 | 135.04 g·mol⁻¹ |
| 外觀 | 黃色至橙色透明有惡臭液體 |
| 密度 | 1.688 g/cm3 |
| 熔點 | –80 °C |
| 沸點 | 137.1 °C |
| 溶解性(水) | 遇水反應,放出氯化氫 |
| 溶解性(其他) | 溶於乙醇、苯、乙醚、氯仿、四氯化碳[1] |
| 蒸氣壓 | 15 hPa(20 °C)[2] |
| 折光度n D |
1.6588(20 °C) |
| 結構 | |
| 配位幾何 | 折線形 |
| 偶極矩 | 1.60 D[1] |
| 危險性 | |
| 警示術語 | R:R14, R20, R25, R29, R35, R50 |
| 安全術語 | S:S1/2, S26, S36/37/39, S45, S61 |
| MSDS | ICSC 0958 |
| 歐盟編號 | 016-012-00-4 |
| 歐盟分類 | 有毒 (T) 有害 (Xn) 腐蝕性 (C) 對環境有害 (N) |
| NFPA 704 | |
| 閃點 | 118.5 °C |
| 自燃溫度 | 234 °C |
| 相關物質 | |
| 相關硫的氯化物 | 二氯化硫 氯化亞碸 硫酰氯 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
二氯化二硫,有時亦作一氯化硫,化學式S2Cl2。
性質[編輯]
二氯化二硫是一種黃紅色液體,有刺激性、窒息性惡臭,在空氣中強烈發煙。遇水分解為硫、二氧化硫、氯化氫。溶於醚、苯、二硫化碳。室溫下穩定,100°C時分解為相應單質,300°C時則完全分解。
能被金屬還原為氯化物和硫化物。與氯氣反應生成二氯化硫。能與金屬氧化物或硫化物反應生成金屬氯化物。
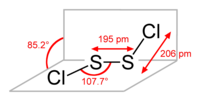
結構[編輯]
二氯化二硫分子為折線型結構,形似一本打開的書,與雙氧水類似,為偏轉構象(gauche)。它有一種結構式為 S=SCl2 異構體,可在二氯化二硫受到紫外輻射時生成,不過壽命很短。
製備[編輯]
1、由硫與限量氯氣在50~60°C反應16~20小時而得。[3]
2、二硫化碳與氯氣在95~100°C反應製取四氯化碳,副產二氯化二硫:[3]
用途[編輯]
在有機合成中用於引入 C–S 鍵。在氯化鋁存在下,與苯反應生成二苯硫醚。與乙烯反應生成芥子氣。也是Herz反應中的試劑。
參考資料[編輯]
- ^ 1.0 1.1 Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0070494398
- ^ Record of Dischwefeldichlorid in the GESTIS Substance Database from the IFA
- ^ 3.0 3.1 中國化工產品大全 上卷,Bc115 一氯化硫,頁125
| 維基共享資源上的相關多媒體資源:二氯化二硫 |
| ||||||||||||||||||||||||||||||||||||||||||||



