氯化銅
| 氯化銅 | |
|---|---|

| |

| |

| |

| |
| IUPAC名 Copper(II) chloride Cupric chloride | |
| 別名 | 氯化銅(II) |
| 識別 | |
| CAS號 | 7447-39-4(無水) 10125-13-0(二水) |
| PubChem | 24014 |
| ChemSpider | 148374 |
| SMILES |
|
| InChI |
|
| InChIKey | ORTQZVOHEJQUHG-LRIOHBSEAE |
| ChEBI | 49553 |
| RTECS | GL7000000 |
| 性質 | |
| 化學式 | CuCl2 |
| 摩爾質量 | (無水)134.45 g/mol (二水)170.48 g·mol⁻¹ |
| 外觀 | 藍綠色固體(二水) 黃棕色固體(無水) |
| 密度 | 3.386 g/cm³ (固) |
| 熔點 | 100°C 失結晶水 |
| 沸點 | 993°C 分解 |
| 溶解性(水) | 70.6 g/100 mL (0 °C) 75.7 g/100 mL (25 °C) |
| 溶解性(甲醇) | 68 g/100 mL (15 °C) |
| 溶解性(乙醇) | 53 g/100 mL (15 °C) |
| 結構 | |
| 晶體結構 | 變形CdI2結構 |
| 配位幾何 | 八面體 |
| 危險性 | |
| MSDS | ScienceLab.com |
| 歐盟分類 | 未列明 |
| NFPA 704 | |
| 閃點 | 不可燃 |
| 相關物質 | |
| 其他陰離子 | 氟化銅,溴化銅,碘化亞銅 |
| 其他陽離子 | 氯化亞銅,氯化銀,三氯化金 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
氯化銅是銅(II)的氯化物,化學式為CuCl2。它是黃棕色固體,在空氣中緩慢吸收水分生成藍綠色的二水合物。自然界中氯化銅存在於很稀有的水氯銅礦中。
結構[編輯]
無水CuCl2為變形碘化鎘結構。由於姜-泰勒效應的緣故,涉及一對配體時,一個d電子定域在強反鍵的分子軌道中,因此大多數銅(II)化合物都與理想的八面體型結構有偏差。在CuCl2(H2O)2中,銅為高度變形的八面體構型,被兩個水分子和四個氯離子配體所包圍,配體還與其他Cu原子不對稱橋聯。[1]
性質[編輯]
氯化銅在水溶液中生成藍色的[Cu(H2O)6]2+和黃紅色的鹵素配離子[CuCl2+x]x-。濃的CuCl2溶液中含有這些帶色離子,呈混合色綠色;稀溶液的顏色則與溫度有關,100°C時為綠色,室溫下為藍色。[2] 氯化銅在火焰中發出藍綠色光。
氯化銅為弱的路易斯酸,也是溫和的氧化劑。其結構中含有扁平CuCl4的多聚長鏈。
氯化銅與鹽酸或其他含氯離子的化合物反應,生成配離子CuCl3−和CuCl42−。[3]
氯化銅還可與其他很多配體反應生成配合物,例如吡啶或三苯基氧化膦:
- CuCl2 + 2 C5H5N → [CuCl2(C5H5N)2] (四面體)
- CuCl2 + 2 (C6H5)3P=O → [CuCl2((C6H5)3P=O)2] (四面體)
但膦一類的「軟」配體,如三苯基膦、碘離子、氰離子和一些叔胺,會還原氯化銅得到一價銅配合物。
為了從氯化銅得到一價銅,常用的方法是用二氧化硫還原其水溶液:
CuCl2可提供Cu2+,用於製備不溶的銅(II)鹽類。例如氯化銅與氫氧化物反應得到不溶氫氧化銅,在30°C以上分解為氧化銅:
分解反應為:
製備[編輯]
無水CuCl2可由單質直接化合得到:
- Cu+Cl2→CuCl2
用CaCl2-冰浴冷卻氯化銅的熱稀鹽酸溶液可以得到純淨的CuCl2。[4]
用途[編輯]
工業上主要用氯化銅作為瓦克法中的催化劑,與氯化鈀(II)共同催化乙烯轉化為乙醛。該法中,PdCl2被還原為Pd,再經CuCl2氧化又得到PdCl2。氯化銅的還原產物CuCl可被通入的空氣氧化回CuCl2,從而完成循環。
(1) C2H4(g) + PdCl2(aq) + H2O (l) → CH3CHO (aq) + Pd(s) + 2 HCl(aq)
(2) Pd(s) + 2 CuCl2(aq) → 2 CuCl(s) + PdCl2(aq)
(3) 2 CuCl(s) + 2 HCl(aq) +1/2O2(g) → 2 CuCl2(aq) + H2O(l)
總反應:C2H4 +1/2O2 → CH3CHO
氯化銅在有機合成中也有很廣泛的應用。[4]氧化鋁存在下,它可以對芳香烴和羰基化合物的α-氫進行氯化:[5]
反應在DMF之類的極性溶劑中進行,且常常加入氯化鋰以加快反應速率。
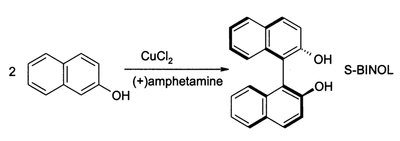
CuCl2在氧氣存在下也可氧化酚,主要產物可以是醌或是氧化二聚所得的偶聯產物。後者可用於合成1,1-聯二萘酚(BINOL)及其衍生物,產率和對映體過量百分數都很高:[6]
這類化合物是合成BINAP時重要的中間體,其衍生物是不對稱氫化反應常用的手性配體。
CuCl2也可催化磺酰氯對烯烴的自由基加成反應,鹼存在下產物α-氯代碸可以發生消除得到乙烯基碸。
焰火中用氯化銅來產生藍綠色光。
參考資料[編輯]
- ^ Wells, A.F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press. ISBN 0-19-855370-6.
- ^ Alfred Swaine Taylor; Robert Eglesfeld Griffith. On Poisons, in Relation to Medical Jurisprudence and Medicine. Lea & Blanchard, 1848, p. 378.
- ^ Gill, N. S.; Taylor, F. B., "Tetrahalo Complexes of Dipositive Metals in the First Transition Series", Inorganic Syntheses, 1967, volume 9, pages 136-142.
- ^ 4.0 4.1 C. E. Castro, E. J. Gaughan, D. C. Owsley, Journal of Organic Chemistry, 30, 587 (1965).
- ^ J. Brussee, J. L. G. Groenendijk, J. M. Koppele, A. C. A. Jansen, Tetrahedron, 41, 3313 (1985).
- ^ Fieser & Fieser Reagents for Organic Synthesis Volume 5, p158, Wiley, New York, 1975.
- Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990.
- The Merck Index, 7th edition, Merck & Co, Rahway, New Jersey, USA, 1960.
- D. Nicholls, Complexes and First-Row Transition Elements, Macmillan Press, London, 1973.
- A. F. Wells, 'Structural Inorganic Chemistry, 5th ed., Oxford University Press, Oxford, UK, 1984.
- J. March, Advanced Organic Chemistry, 4th ed., p. 723, Wiley, New York, 1992.
- S. H. Bertz, E. H. Fairchild, in Handbook of Reagents for Organic Synthesis, Volume 1: Reagents, Auxiliaries and Catalysts for C-C Bond Formation, (R. M. Coates, S. E. Denmark, eds.), pp. 220-3, Wiley, New York, 1999.
- D. W. Smith. Chlorocuprates(II). Coordination Chemistry Reviews. 1976, 21 (2-3): 93–158. doi:10.1016/S0010-8545(00)80445-2.
外部連結[編輯]
| ||||||||||||||||||||||||||||||||||||