米氏酸
| 米氏酸 | |||
|---|---|---|---|
| |||
| IUPAC名 2,2-dimethyl-1,3-dioxane-4,6-dione 2,2-二甲基-1,3-二氧六環-4,6-二酮 | |||
| 識別 | |||
| CAS號 | 2033-24-1 | ||
| ChemSpider | 15418 | ||
| SMILES |
| ||
| InChIKey | GXHFUVWIGNLZSC-UHFFFAOYAM | ||
| 性質 | |||
| 化學式 | C6H8O4 | ||
| 摩爾質量 | 144.13 g·mol−1 | ||
| 外觀 | 白色針狀晶體 | ||
| 熔點 | 96 °C(369 K) | ||
| pKa | 4.97 | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
米氏酸(Meldrum's acid),又名Meldrum 酸、丙二酸亞異丙酯,學名2,2-二甲基-1,3-二氧六環-4,6-二酮;2,2-二甲基-1,3-二噁烷-4,6-二酮。一種白色針狀晶體,易溶於有機溶劑和鹼性水溶液。熔點96攝氏度。
製備[編輯]
由丙二酸、丙酮和醋酐混合物在冰水浴冷卻下滴加濃硫酸催化合成。醋酐起到活化羧酸的作用。
也可用丙二酸與醋酸2-丙烯酯在酸催化下合成。
歷史[編輯]
由蘇格蘭人米爾壯(Meldrum)於1908年合成[1]。米爾壯根據這個晶體可以溶解在碳酸氫鈉溶液里的特性斷定裏面含有羧基。給出了下面的結構:

過了40年,這個結構被戴維森(Davidson)和博哈德(Bernhard)證明是錯誤的。[2] 一個正確的丙二內酯的結構被提了出來。而且米氏酸呈酸性的原因被正確地歸因於活潑亞甲基的電離。又過了40年,克萊倫斯(Clarence)和波義爾(Boyle)根據X射線晶體繞射結果指出這個「酸」的穩定構象是船式構象,並將原因歸結為酯官能團為了維持平面結構的結果。[3] 阿內特隨即指出這個酸在互變異構平衡溶液里烯醇式含量微乎其微。[4]
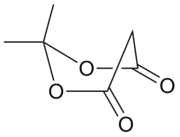
酸性之謎[編輯]
米氏酸是最容易電離的1,3-二羰基化合物。其 pKa 低達4.97,與普通羧酸相仿。米氏酸超乎尋常的高酸性在過去100年始終沒有得到一個徹底完美的解釋,也因此成為理論有機化學中的一個著名難題。
最早的解釋是基於偶極分析。阿恩特後來提出了基於立體電子效應的解釋。阿恩特指出,普通的酯由於烷氧原子上的兩個孤對電子與羰基存在兩種可能的共軛:一個是與羰基π鍵最低空軌道的共軛;一個是與羰基σ鍵反鍵軌道的共軛。這兩種共軛可以降低分子能量,是分子處於更穩定的狀態,所以普通酯基態的優勢構象是Z式(見下圖)。由於環的存在,米氏酸的內酯結構迫使兩半酯處於E式,這樣就阻止了孤對電子與羰基σ鍵反鍵軌道的共軛作用,其結果是羰基的親電性增強從而能更有效地穩定α-碳負離子。由於是兩半酯共同作用於一個亞甲基,相當於兩倍的效果,所以米氏酸比普通內酯的酸性還要高很多。

這個解釋能比較好的解釋米氏酸的高酸度,但是後來的能量衡算發現這個解釋只解釋了50%的原因,尚有剩下50%解釋不了。在2001年和2004年有人分別用量子化學對這個酸做了不同的計算,從更多的角度提出了解釋。但迄今為止這個問題仍然有很大的探討空間。
應用[編輯]
米氏酸在有機合成上有着廣泛的應用。由於極易烯醇化,所以作為一個很好的親核試劑參與諸多反應。在很多丙二酸二酯反應效果不好的場合能很好的參與反應。

參考文獻[編輯]
- ^ Meldrum, Andrew Norman. A β-lactonic acid from acetone and malonic acid. Journal of the Chemical Society, Transactions. 1908, 93: 598 – 601. doi:10.1039/CT9089300598.
- ^ Davidson, David; Bernhard, Sidney A. The Structure of Meldrum's Supposed β-Lactonic Acid. Journal of the American Chemical Society. 1948, 70 (10): 3426 – 3428. doi:10.1021/ja01190a060.
- ^ Clarence E. Pfluger and Paul D. Boyle. Conformation and intermolecular interactions of Meldrum's acid: an X-ray structural investigation of 2,2-dimethyl-1,3-dioxane-4,6-dione. Journal of the Chemical Society, Transactions II. 1985: 1547 – 1549. doi:10.1039/P29850001547.
- ^ Arnett, E. M.and Harrelson, J. A. Gazz. Chim. Ital. 1987, 117: 237. 缺少或
|title=為空 (幫助)


