胞質溶膠

胞質溶膠(英語:cytosol)或稱胞質液[2],舊稱細胞質基質[3](cytoplasmic matrix)、細胞內液(intracellular fluid ,ICF)、基本細胞質(fundamental/ground cytoplasm)、透明質(hyaloplasm)[4],屬於細胞質的組分,是細胞質除去胞器和其他顆粒,較為均質、半透明的液態膠狀物質[5]。(類似線粒體基質將線粒體分離成許多區室的液體基質溶膠。)
胞質溶膠充滿於細胞內的各種膜系構造之間,含有胞內各種可溶成分,例如:小分子和各種離子、中等分子(脂類、糖、氨基酸)和大分子(蛋白質、RNA),它負載着各種細胞器和顆粒,成為它們的輸導流體和活動介質。
在真核細胞中,胞質溶膠被細胞膜包圍,是細胞質的一部分;但細胞質涵蓋的範圍較胞質溶膠廣泛,也包含了線粒體,質體和其他細胞器。因此,胞質溶膠是細胞器周圍的液體基質溶膠。在原核生物中,代謝的大部分化學反應發生在胞質溶膠中,而少數發生在膜或周質空間中。在真核生物中,雖然許多代謝途徑仍然存在於胞質溶膠中,但其他途徑發生在細胞器內。
胞質溶膠是溶解在水中的物質的複雜混合物。 儘管水構成大部分胞質溶膠,但是,其在細胞內的結構和性質尚不清楚。 細胞質中鈉離子和鉀離子的濃度不同於細胞外液中的濃度; 這些離子水平的差異在諸如滲透壓調節,細胞信號傳送和可興奮細胞,例如內分泌,神經和肌肉細胞中的動作電位的產生的過程中是重要的。 胞質溶膠還含有大量的高分子,通過大分子擁擠可以改變分子的行為方式。
雖然它曾被認為是一種簡單的分子溶液,但是,胞質溶膠具有多種組織水平。 這些包括小分子的濃度梯度,例如鈣,一起作用並參與代謝途徑的酶的大複合體,以及蛋白質複合體,例如包圍和分離胞質溶膠部分的蛋白酶體和羧酶體。
性質和組成[編輯]
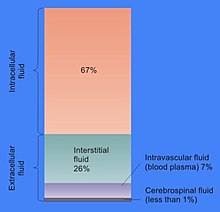
胞質溶膠的細胞體積比例各不相同:例如,當在細菌中這個區室形成大部分細胞結構時,在植物細胞中,主要區室是大的中央液胞[6]。 胞質溶膠主要由水,溶解的離子,小分子和大的水溶性分子(如蛋白質)組成。 大多數這些非蛋白質分子的分子量小於300 Da。 這種小分子混合物非常複雜,因為參與代謝的分子(代謝產物)種類多樣性是巨大的。 例如,在植物中可能產生多達200,000種不同的小分子,儘管並非所有這些小分子都存在於同一物種或單一細胞中[7] 。 單個細胞中代謝產物數量的估計預測不到1000個,例如大腸桿菌和麵包酵母[8][9]。
水[編輯]
胞質溶膠的大部分是水,占典型細胞總體積的70%左右[10]。 細胞內液的pH值為7.4[11] 。 而人體胞質溶膠pH值範圍在7.0-7.4之間,如果細胞生長則通常更高[12]。 胞質溶膠的粘度與純水大致相同,儘管小分子通過這種液體的擴散作用比純水慢四倍,這主要是由於胞質溶膠中大量高分子的碰撞[13]。 對於鹽水蝦的研究已經檢查了水如何影響細胞功能; 他們發現細胞內水分減少20%會抑制新陳代謝,隨着細胞逐漸乾涸,新陳代謝活動逐漸減少,當水分低於正常值時,所有代謝活動都會停止[14]。
儘管水對生命至關重要,但胞質溶膠中這種水的結構尚不清楚,主要是因為核磁共振波譜法等方法只能提供水的平均結構信息,而不能測量微觀尺度的局部變化。 由於水能夠通過氫鍵形成諸如水分子簇之類的結構,因此甚至對純水的結構也知之甚少[15]。
對於細胞中水的經典觀點是,約5%的水被溶質或大分子強烈地結合為溶劑化的水,而大多數水具有與純水相同的結構[14]。這種溶劑化的水在滲透中沒有活性,可能具有不同的溶劑性質,因此有一些溶解的分子被排除在外,而另外有一些則變得濃縮[16][17]。然而,其他人則認為細胞中高濃度大分子的影響會延伸到整個細胞質中,並且細胞中的水與稀釋溶液中的水的作用非常不同[18]。這些想法包括細胞含有低密度和高密度水的區域的提議,這些區域可能對細胞其他部分的結構和功能產生廣泛影響[15][19]。然而,使用先進的核磁共振波譜法方法直接測量活細胞中水的流動性與這一觀點相矛盾,因為它表明85%的細胞水就像純水一樣,而其餘的則不太流動,可能與大分子結合[20]。
離子[編輯]
胞質溶膠中其他離子的濃度與細胞外液中的濃度完全不同,並且胞質溶膠還含有比細胞結構外部高得多的帶電高分子,例如蛋白質和核酸。
| 離子 | 胞質溶膠中的濃度 (mM) | 血液中的濃度 (mM) |
|---|---|---|
| 鉀 | 139 | 4 |
| 鈉 | 12 | 145 |
| 氯化物 | 4 | 116 |
| 碳酸氫鹽 | 12 | 29 |
| 蛋白質中的氨基酸 | 138 | 9 |
| 鎂 | 0.8 | 1.5 |
| 鈣 | <0.0002 | 1.8 |
與細胞外液相反,胞質溶膠具有高濃度的鉀離子和低濃度的鈉離子[22]。離子濃度的這種差異對於滲透壓調節是至關重要的,因為如果離子水平在細胞內與外部相同,則水會通過滲透不斷進入 - 因為細胞內的大分子水平高於其外部的水平。 相反,鈉離子被排出並且鉀離子被鈉鉀泵(Na⁺/K⁺-ATPase酶)吸收,然後鉀離子通過鉀選擇離子通道向下流過它們的濃度梯度,這種正電荷的損失產生負膜電位。 為了平衡這種電位差,負氯離子也通過選擇性氯離子通道離開細胞。 鈉離子和氯離子的損失彌補了細胞內有機分子濃度較高的滲透作用[22]。
通過在細胞質中積累滲透保護劑例如甜菜鹼或海藻糖,細胞可以處理更大的滲透變化[22]。 這些分子中的一些可以使細胞在完全乾燥的情況下存活,並使生物體進入稱為隱生的假死狀態[23]。 在這種狀態下,細胞溶質和滲透保護劑變成玻璃狀固體,有助於穩定蛋白質和細胞膜免受乾燥的破壞作用[24]。
胞質溶膠中的低濃度鈣允許鈣離子在鈣信號傳送中起第二信使的作用。 在這裏,諸如激素或動作電位的信號打開鈣通道,使鈣湧入胞質溶膠[25] 。 胞質溶膠鈣的這種突然增加激活了其他信號分子,如鈣調蛋白和蛋白激酶C[26]。 其他離子如氯化物和鉀也可能在胞質溶膠中具有信號傳送功能,但這些並不十分清楚[27]。
大分子[編輯]
那些沒有與細胞膜或細胞骨架結合的蛋白質分子溶解在胞質溶膠中。 細胞中的蛋白質含量非常高,接近200 mg/ml,占胞質溶膠體積的20-30%[28]。 然而,準確測量蛋白質在完整細胞中溶解在胞質溶膠中的程度是困難的,因為一些蛋白質似乎與整個細胞中的細胞膜或細胞器弱相關,並在細胞溶菌(lysis)後釋放到溶液中[14]。實際上,在使用皂苷小心地破壞細胞質膜而不損害其他細胞膜的實驗中,僅釋放了約四分之一的細胞蛋白質。 如果給定ATP和氨基酸,這些細胞也能夠合成蛋白質,這意味着細胞質中的許多酶與細胞骨架結合[29]。 然而,現在認為細胞中的大多數蛋白質在稱為微小梁晶格的網絡中緊密結合的觀點是不太可能的[30]。
在原核生物中,胞質溶膠包含細胞的基因組,在被稱為擬核的結構中[31]。 這是一種DNA和相關蛋白質的不規則塊,可控制細菌染色體和質體的轉錄和複製。 在真核生物中,基因組被保持在細胞核內,細胞核通過核孔與胞質溶膠分離,核孔阻止直徑大於約10納米的任何分子的自由擴散[32]。
胞質溶膠中這種高濃度的大分子會產生一種稱為大分子擁擠(Macromolecular crowding)的效應,即當其他大分子的有效濃度被增加,因為它們較小的體積移入。這種擁擠效應會導致細胞質中反應的化學平衡在中的速率和位置發生較大變化[28] 。 特別重要的是它能夠通過促進大分子的結合來改變解離常數,例如當多種蛋白質結合在一起形成蛋白質複合體時,或者當DNA結合蛋白質與基因組中的靶標結合時[33] 。
組織[編輯]
儘管胞質溶膠的成分不是通過細胞膜分離成區域,但這些成分並不總是隨機混合,並且幾種組織層次可以將特定分子定位於胞質溶膠內的確定位點[34]。
濃度梯度[編輯]
儘管小分子在胞質溶膠中快速擴散,但仍可在該區室內產生濃度梯度。 一個充分研究的例子是在開放的鈣通道周圍區域短時間內產生的「鈣火花」[35]。 它們直徑約為2微米,持續時間僅為幾毫秒,但有幾個火花可以合併形成更大的梯度,稱為「鈣波」[36]。 其他小分子(如氧和三磷酸腺苷)的濃度梯度可能會在線粒體簇周圍的細胞中產生,儘管這些都不太了解[37][38]。
蛋白質複合體[編輯]
蛋白質可以結合形成蛋白質複合體,這些蛋白質複合體通常含有一組具有相似功能的蛋白質,例如在相同代謝途徑中進行多個步驟的酶[39]。該組織可以允許底物通道(Substrate channeling),即當一種酶的產物直接被通過給在代謝途徑中的下一種酶而不釋放到溶液中時[40] 。 如果酶在細胞質中隨機分佈,通道可以使代謝途徑更快速和有效,並且還可以防止不穩定的反應中間體的釋放[41]。 儘管各種各樣的代謝途徑涉及彼此緊密結合的酶,但其他代謝途徑可能涉及更難以在細胞外研究的鬆散相關的複合體[42][43]。 因此,這些複合體在新陳代謝中的重要性一般尚不清楚。

蛋白質隔室[編輯]
一些蛋白質複合物含有大的中心腔,與胞質溶膠的其餘部分分離。 這種封閉隔室的一個例子是蛋白酶體[44]。 這裏,一組亞基形成含有降解胞質蛋白的蛋白酶的空心桶。 如果它們與胞質溶膠的其餘部分自由混合,這些將是被損害的,因此桶被一組調節蛋白封頂,所述調節蛋白識別具有指導它們降解的信號的蛋白質(一種泛素標籤)並將它們進料到蛋白水解腔體中[45]。
另一大類蛋白質區室是細菌微區室(Bacterial microcompartment),它由包裹各種酶的蛋白質外殼製成[46]。 這些隔室通常約100-200納米,由互鎖蛋白製成[47]。 一個眾所周知的例子是羧酶體,它包含碳固定中涉及的酶,如RuBisCO[48]。
生物分子縮合物[編輯]
非膜結合的細胞器可以形成為生物分子縮合物,其通過高分子的聚集,寡聚化或聚合而產生,以驅動細胞質或細胞核的膠體相分離。
細胞骨架篩分[編輯]
雖然細胞骨架不是胞質溶膠的一部分,但是這種細絲網絡的存在限制了細胞中大顆粒的擴散。 例如,在一些研究中,大於約25納米(相當於為核糖體大小)[49]的示蹤粒子被排除在細胞邊緣和細胞核附近的細胞質部分之外[50][51]。 這些「排除隔室」可包含比胞質溶膠的其餘部分更密集的肌動蛋白纖維網狀物。 這些微區可以通過從某些區域排除它們並將它們集中在其他區域來影響細胞質內的核糖體和細胞器等大型結構的分佈[52]。
功能[編輯]
胞質溶膠沒有單一功能,而是許多個細胞過程的發生位置。 這些過程的例子包括從細胞膜到細胞內部特定位置的信號轉送,如導向細胞核[53],或細胞器[54]。 在有絲分裂中核膜破裂後,胞質溶膠也是細胞質分裂的許多過程的所在地[55]。胞質溶膠的另一個主要功能是將代謝物從其生產地運輸到使用它們的地方。 這對於水溶性分子(如氨基酸)來說相對簡單,它可以通過細胞質迅速擴散[13]。然而,疏水性分子,如脂肪酸或固醇,可以通過特異性結合蛋白通過胞質溶膠轉送,特異性結合蛋白將這些分子在細胞膜之間穿梭[56][57]。 通過內吞作用或分泌途徑進入細胞的分子也可以通過在細胞質的囊泡內被運輸[58],這囊泡是被馬達蛋白攜帶沿着細胞骨架移動的脂質小球[59]。
胞質溶膠是原核生物[60]和真核生物的大部分代謝作用的發生位置。 例如,在哺乳動物中,細胞中大約一半的蛋白質被定位於胞質溶膠[61]。 最完整的數據可在酵母中獲得,其中代謝重建表明大部分代謝過程和代謝產物都發生在胞質溶膠中[62]。 動物細胞質中發生的主要代謝途徑是蛋白質生物合成,磷酸戊糖途徑,糖酵解和糖異生[63]。在其他生物體中,途徑的定位可以是不同的,例如植物的脂肪酸合成發生在葉綠體中[64][65],頂複門生物發生在頂質體中[66]。
參考資料[編輯]
- ^ Goodsell DS. Inside a living cell. Trends Biochem. Sci. June 1991, 16 (6): 203–6. PMID 1891800. doi:10.1016/0968-0004(91)90083-8.
- ^ 存档副本. [2021-07-06]. (原始內容存檔於2022-04-19).
- ^ 存档副本. [2021-07-06]. (原始內容存檔於2022-06-03).
- ^ Cammack, Richard CammackRichard; Atwood, Teresa AtwoodTeresa; Campbell, Peter CampbellPeter; Parish, Howard ParishHoward; Smith, Anthony SmithAnthony; Vella, Frank VellaFrank; Stirling, John StirlingJohn. Cytoplasmic matrix. Oxford Dictionary of Biochemistry and Molecular Biology. Oxford University Press. 2006 [2019-08-10]. ISBN 9780198529170. doi:10.1093/acref/9780198529170.001.0001. (原始內容存檔於2020-04-27) (英語).
- ^ Brown, Thomas A. Rapid Review Physiology. Elsevier Health Sciences. 2011: 2 [2019-08-10]. ISBN 978-0323072601. (原始內容存檔於2018-12-25) (英語).
- ^ Bowsher CG, Tobin AK. Compartmentation of metabolism within mitochondria and plastids. J. Exp. Bot. April 2001, 52 (356): 513–27. PMID 11373301. doi:10.1093/jexbot/52.356.513.
- ^ Weckwerth W. Metabolomics in systems biology. Annu Rev Plant Biol. 2003, 54: 669–89. PMID 14503007. doi:10.1146/annurev.arplant.54.031902.135014.
- ^ Reed JL, Vo TD, Schilling CH, Palsson BO. An expanded genome-scale model of Escherichia coli K-12 (iJR904 GSM/GPR). Genome Biol. 2003, 4 (9): R54. PMC 193654
 . PMID 12952533. doi:10.1186/gb-2003-4-9-r54.
. PMID 12952533. doi:10.1186/gb-2003-4-9-r54.
- ^ Förster J, Famili I, Fu P, Palsson BØ, Nielsen J. Genome-Scale Reconstruction of the Saccharomyces cerevisiae Metabolic Network. Genome Res. February 2003, 13 (2): 244–53. PMC 420374
 . PMID 12566402. doi:10.1101/gr.234503.
. PMID 12566402. doi:10.1101/gr.234503.
- ^ Luby-Phelps K. Cytoarchitecture and physical properties of cytoplasm: volume, viscosity, diffusion, intracellular surface area (PDF). Int. Rev. Cytol. International Review of Cytology. 2000, 192: 189–221. ISBN 978-0-12-364596-8. PMID 10553280. doi:10.1016/S0074-7696(08)60527-6. (原始內容 (PDF)存檔於2011-07-19).
- ^ Roos A, Boron WF. Intracellular pH. Physiol. Rev. April 1981, 61 (2): 296–434. PMID 7012859. doi:10.1152/physrev.1981.61.2.296.
- ^ Bright, G R; Fisher, GW; Rogowska, J; Taylor, DL. Fluorescence ratio imaging microscopy: temporal and spatial measurements of cytoplasmic pH. The Journal of Cell Biology. 1987, 104 (4): 1019–1033. PMC 2114443
 . PMID 3558476. doi:10.1083/jcb.104.4.1019.
. PMID 3558476. doi:10.1083/jcb.104.4.1019.
- ^ 13.0 13.1 Verkman AS. Solute and macromolecule diffusion in cellular aqueous compartments. Trends Biochem. Sci. January 2002, 27 (1): 27–33. PMID 11796221. doi:10.1016/S0968-0004(01)02003-5.
- ^ 14.0 14.1 14.2 Clegg James S. Properties and metabolism of the aqueous cytoplasm and its boundaries. Am. J. Physiol. 1984, 246 (2 Pt 2): R133–51. PMID 6364846. doi:10.1152/ajpregu.1984.246.2.R133.

- ^ 15.0 15.1 Wiggins PM. Role of water in some biological processes. Microbiol. Rev. 1 December 1990, 54 (4): 432–49 [2019-08-10]. PMC 372788
 . PMID 2087221. (原始內容存檔於2011-06-11).
. PMID 2087221. (原始內容存檔於2011-06-11).
- ^ Fulton AB. How crowded is the cytoplasm?. Cell. September 1982, 30 (2): 345–7. PMID 6754085. doi:10.1016/0092-8674(82)90231-8.
- ^ Garlid KD. The state of water in biological systems. Int. Rev. Cytol. International Review of Cytology. 2000, 192: 281–302. ISBN 978-0-12-364596-8. PMID 10553283. doi:10.1016/S0074-7696(08)60530-6.
- ^ Chaplin M. Do we underestimate the importance of water in cell biology?. Nat. Rev. Mol. Cell Biol. November 2006, 7 (11): 861–6. PMID 16955076. doi:10.1038/nrm2021.
- ^ Wiggins PM. High and low density water and resting, active and transformed cells. Cell Biol. Int. June 1996, 20 (6): 429–35. PMID 8963257. doi:10.1006/cbir.1996.0054.
- ^ Persson E, Halle B. Cell water dynamics on multiple time scales. Proc. Natl. Acad. Sci. U.S.A. April 2008, 105 (17): 6266–71. PMC 2359779
 . PMID 18436650. doi:10.1073/pnas.0709585105.
. PMID 18436650. doi:10.1073/pnas.0709585105.
- ^ Lodish, Harvey F. Molecular cell biology. New York: Scientific American Books. 1999. ISBN 0-7167-3136-3. OCLC 174431482.
- ^ 22.0 22.1 22.2 Lang F. Mechanisms and significance of cell volume regulation. J Am Coll Nutr. October 2007, 26 (5 Suppl): 613S–623S. PMID 17921474. doi:10.1080/07315724.2007.10719667.
- ^ Sussich F, Skopec C, Brady J, Cesàro A. Reversible dehydration of trehalose and anhydrobiosis: from solution state to an exotic crystal?. Carbohydr. Res. August 2001, 334 (3): 165–76. PMID 11513823. doi:10.1016/S0008-6215(01)00189-6.
- ^ Crowe JH, Carpenter JF, Crowe LM. The role of vitrification in anhydrobiosis. Annu. Rev. Physiol. 1998, 60: 73–103. PMID 9558455. doi:10.1146/annurev.physiol.60.1.73.
- ^ Berridge MJ. Elementary and global aspects of calcium signalling. J. Physiol. 1 March 1997, 499 (Pt 2): 291–306 [2019-08-10]. PMC 1159305
 . PMID 9080360. doi:10.1113/jphysiol.1997.sp021927. (原始內容存檔於2020-05-26).
. PMID 9080360. doi:10.1113/jphysiol.1997.sp021927. (原始內容存檔於2020-05-26).
- ^ Kikkawa U, Kishimoto A, Nishizuka Y. The protein kinase C family: heterogeneity and its implications. Annu. Rev. Biochem. 1989, 58: 31–44. PMID 2549852. doi:10.1146/annurev.bi.58.070189.000335.
- ^ Orlov SN, Hamet P. Intracellular monovalent ions as second messengers. J. Membr. Biol. April 2006, 210 (3): 161–72. PMID 16909338. doi:10.1007/s00232-006-0857-9.
- ^ 28.0 28.1 Ellis RJ. Macromolecular crowding: obvious but underappreciated. Trends Biochem. Sci. October 2001, 26 (10): 597–604. PMID 11590012. doi:10.1016/S0968-0004(01)01938-7.
- ^ Hudder A, Nathanson L, Deutscher MP. Organization of Mammalian Cytoplasm. Mol. Cell. Biol. December 2003, 23 (24): 9318–26. PMC 309675
 . PMID 14645541. doi:10.1128/MCB.23.24.9318-9326.2003.
. PMID 14645541. doi:10.1128/MCB.23.24.9318-9326.2003.
- ^ Heuser J. Whatever happened to the 'microtrabecular concept'?. Biol Cell. 2002, 94 (9): 561–96. PMID 12732437. doi:10.1016/S0248-4900(02)00013-8.
- ^ Thanbichler M, Wang S, Shapiro L. The bacterial nucleoid: a highly organized and dynamic structure. J Cell Biochem. 2005, 96 (3): 506–21. PMID 15988757. doi:10.1002/jcb.20519.
- ^ Peters R. Introduction to nucleocytoplasmic transport: molecules and mechanisms. Methods Mol. Biol. Methods in Molecular Biology™. 2006, 322: 235–58. ISBN 978-1-58829-362-6. PMID 16739728. doi:10.1007/978-1-59745-000-3_17.
- ^ Zhou HX, Rivas G, Minton AP. Macromolecular crowding and confinement: biochemical, biophysical, and potential physiological consequences. Annu Rev Biophys. 2008, 37: 375–97. PMC 2826134
 . PMID 18573087. doi:10.1146/annurev.biophys.37.032807.125817.
. PMID 18573087. doi:10.1146/annurev.biophys.37.032807.125817.
- ^ Norris V, den Blaauwen T, Cabin-Flaman A. Functional Taxonomy of Bacterial Hyperstructures. Microbiol. Mol. Biol. Rev. March 2007, 71 (1): 230–53. PMC 1847379
 . PMID 17347523. doi:10.1128/MMBR.00035-06.
. PMID 17347523. doi:10.1128/MMBR.00035-06.
- ^ Wang SQ, Wei C, Zhao G. Imaging microdomain Ca2+ in muscle cells. Circ. Res. April 2004, 94 (8): 1011–22. PMID 15117829. doi:10.1161/01.RES.0000125883.68447.A1.
- ^ Jaffe LF. Classes and mechanisms of calcium waves. Cell Calcium. November 1993, 14 (10): 736–45. PMID 8131190. doi:10.1016/0143-4160(93)90099-R.
- ^ Aw, T.Y. Intracellular compartmentation of organelles and gradients of low molecular weight species. Int Rev Cytol. International Review of Cytology. 2000, 192: 223–53. ISBN 978-0-12-364596-8. PMID 10553281. doi:10.1016/S0074-7696(08)60528-8.
- ^ Weiss JN, Korge P. The cytoplasm: no longer a well-mixed bag. Circ. Res. 20 July 2001, 89 (2): 108–10. PMID 11463714. doi:10.1161/res.89.2.108.
- ^ Srere PA. Complexes of sequential metabolic enzymes. Annu. Rev. Biochem. 1987, 56: 89–124. PMID 2441660. doi:10.1146/annurev.bi.56.070187.000513.
- ^ Perham RN. Swinging arms and swinging domains in multifunctional enzymes: catalytic machines for multistep reactions. Annu. Rev. Biochem. 2000, 69: 961–1004. PMID 10966480. doi:10.1146/annurev.biochem.69.1.961.
- ^ Huang X, Holden HM, Raushel FM. Channeling of substrates and intermediates in enzyme-catalyzed reactions. Annu. Rev. Biochem. 2001, 70: 149–80. PMID 11395405. doi:10.1146/annurev.biochem.70.1.149.
- ^ Mowbray J, Moses V. The tentative identification in Escherichia coli of a multienzyme complex with glycolytic activity. Eur. J. Biochem. June 1976, 66 (1): 25–36. PMID 133800. doi:10.1111/j.1432-1033.1976.tb10421.x.
- ^ Srivastava DK, Bernhard SA. Metabolite transfer via enzyme-enzyme complexes. Science. November 1986, 234 (4780): 1081–6. PMID 3775377. doi:10.1126/science.3775377.
- ^ Groll M, Clausen T. Molecular shredders: how proteasomes fulfill their role. Curr. Opin. Struct. Biol. December 2003, 13 (6): 665–73. PMID 14675543. doi:10.1016/j.sbi.2003.10.005.
- ^ Nandi D, Tahiliani P, Kumar A, Chandu D. The ubiquitin-proteasome system (PDF). J. Biosci. March 2006, 31 (1): 137–55 [2019-08-11]. PMID 16595883. doi:10.1007/BF02705243. (原始內容存檔 (PDF)於2019-08-11).
- ^ Bobik, T. A. Bacterial Microcompartments (PDF). Microbe (Am Soc Microbiol). 2007, 2: 25–31. (原始內容 (PDF)存檔於2008-08-02).
- ^ Yeates TO, Kerfeld CA, Heinhorst S, Cannon GC, Shively JM. Protein-based organelles in bacteria: carboxysomes and related microcompartments. Nat. Rev. Microbiol. August 2008, 6 (9): 681–691. PMID 18679172. doi:10.1038/nrmicro1913.
- ^ Badger MR, Price GD. CO2 concentrating mechanisms in cyanobacteria: molecular components, their diversity and evolution. J. Exp. Bot. February 2003, 54 (383): 609–22. PMID 12554704. doi:10.1093/jxb/erg076.
- ^ Cate JH. Construction of low-resolution x-ray crystallographic electron density maps of the ribosome. Methods. November 2001, 25 (3): 303–8 [2019-08-11]. PMID 11860284. doi:10.1006/meth.2001.1242. (原始內容存檔於2019-08-11).
- ^ Provance DW, McDowall A, Marko M, Luby-Phelps K. Cytoarchitecture of size-excluding compartments in living cells. J. Cell Sci. 1 October 1993, 106 (2): 565–77 [2019-08-11]. PMID 7980739. (原始內容存檔於2020-03-26).
- ^ Luby-Phelps K, Castle PE, Taylor DL, Lanni F. Hindered diffusion of inert tracer particles in the cytoplasm of mouse 3T3 cells. Proc. Natl. Acad. Sci. U.S.A. July 1987, 84 (14): 4910–3. PMC 305216
 . PMID 3474634. doi:10.1073/pnas.84.14.4910.
. PMID 3474634. doi:10.1073/pnas.84.14.4910.
- ^ Luby-Phelps K. Effect of cytoarchitecture on the transport and localization of protein synthetic machinery. J. Cell. Biochem. June 1993, 52 (2): 140–7. PMID 8366131. doi:10.1002/jcb.240520205.
- ^ Kholodenko BN. Four-dimensional organization of protein kinase signaling cascades: the roles of diffusion, endocytosis and molecular motors. J. Exp. Biol. June 2003, 206 (Pt 12): 2073–82. PMID 12756289. doi:10.1242/jeb.00298.
- ^ Pesaresi P, Schneider A, Kleine T, Leister D. Interorganellar communication. Curr. Opin. Plant Biol. December 2007, 10 (6): 600–6. PMID 17719262. doi:10.1016/j.pbi.2007.07.007.
- ^ Winey M, Mamay CL, O'Toole ET. Three-dimensional ultrastructural analysis of the Saccharomyces cerevisiae mitotic spindle. J. Cell Biol. June 1995, 129 (6): 1601–15 [2019-08-11]. PMC 2291174
 . PMID 7790357. doi:10.1083/jcb.129.6.1601. (原始內容存檔於2005-08-24).
. PMID 7790357. doi:10.1083/jcb.129.6.1601. (原始內容存檔於2005-08-24).
- ^ Weisiger RA. Cytosolic fatty acid binding proteins catalyze two distinct steps in intracellular transport of their ligands. Mol. Cell. Biochem. October 2002, 239 (1–2): 35–43. PMID 12479566. doi:10.1023/A:1020550405578.
- ^ Maxfield FR, Mondal M. Sterol and lipid trafficking in mammalian cells. Biochem. Soc. Trans. June 2006, 34 (Pt 3): 335–9. PMID 16709155. doi:10.1042/BST0340335.
- ^ Pelham HR. The Croonian Lecture 1999. Intracellular membrane traffic: getting proteins sorted. Philos. Trans. R. Soc. Lond. B Biol. Sci. August 1999, 354 (1388): 1471–8. PMC 1692657
 . PMID 10515003. doi:10.1098/rstb.1999.0491.
. PMID 10515003. doi:10.1098/rstb.1999.0491.
- ^ Kamal A, Goldstein LS. Principles of cargo attachment to cytoplasmic motor proteins. Curr. Opin. Cell Biol. February 2002, 14 (1): 63–8. PMID 11792546. doi:10.1016/S0955-0674(01)00295-2.
- ^ Hoppert M, Mayer F. Principles of macromolecular organization and cell function in bacteria and archaea. Cell Biochem. Biophys. 1999, 31 (3): 247–84. PMID 10736750. doi:10.1007/BF02738242.
- ^ Foster LJ, de Hoog CL, Zhang Y. A mammalian organelle map by protein correlation profiling. Cell. April 2006, 125 (1): 187–99. PMID 16615899. doi:10.1016/j.cell.2006.03.022.
- ^ Herrgård, MJ; Swainston, N; Dobson, P; Dunn, WB; Arga, KY; Arvas, M; Blüthgen, N; Borger, S; Costenoble, R; et al. A consensus yeast metabolic network reconstruction obtained from a community approach to systems biology. Nature Biotechnology. October 2008, 26 (10): 1155–60. PMC 4018421
 . PMID 18846089. doi:10.1038/nbt1492.
. PMID 18846089. doi:10.1038/nbt1492.
- ^ Stryer, Lubert; Berg, Jeremy Mark; Tymoczko, John L. Biochemistry. San Francisco: W.H. Freeman. 2002. ISBN 0-7167-4684-0. OCLC 179705944.
- ^ Ohlrogge J, Pollard M, Bao X. Fatty acid synthesis: from CO2 to functional genomics. Biochem. Soc. Trans. December 2000, 28 (6): 567–73. PMID 11171129. doi:10.1042/BST0280567.
- ^ Ohlrogge JB, Kuhn DN, Stumpf PK. Subcellular localization of acyl carrier protein in leaf protoplasts of Spinacia oleracea. Proc. Natl. Acad. Sci. U.S.A. March 1979, 76 (3): 1194–8. PMC 383216
 . PMID 286305. doi:10.1073/pnas.76.3.1194.
. PMID 286305. doi:10.1073/pnas.76.3.1194.
- ^ Goodman CD, McFadden GI. Fatty acid biosynthesis as a drug target in apicomplexan parasites. Curr Drug Targets. January 2007, 8 (1): 15–30. PMID 17266528. doi:10.2174/138945007779315579.
延伸閱讀[編輯]
- Wheatley, Denys N.; Pollack, Gerald H.; Cameron, Ivan L. Water and the Cell. Berlin: Springer. 2006. ISBN 1-4020-4926-9. OCLC 71298997.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
