四氟化氙
| 四氟化氙 | |||
|---|---|---|---|

| |||
| |||
| IUPAC名 Xenon tetrafluoride | |||
| 別名 | 氟化氙(IV) | ||
| 識別 | |||
| CAS編號 | 13709-61-0 | ||
| PubChem | 123324 | ||
| ChemSpider | 109927 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | RPSSQXXJRBEGEE-UHFFFAOYAW | ||
| 性質 | |||
| 化學式 | XeF4 | ||
| 摩爾質量 | 207.2836 g·mol⁻¹ | ||
| 外觀 | 白色固體 | ||
| 密度 | 4.040 g/cm3 (固) | ||
| 升華條件 | 117 °C (390 K)[1] | ||
| 結構 | |||
| 配位幾何 | D4h | ||
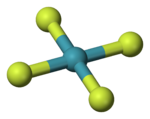
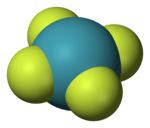
| 分子構型 | 平面正方形 | ||
| 偶極矩 | 0 D | ||
| 危險性 | |||
| 閃點 | ? °C | ||
| 相關物質 | |||
| 相關化學品 | 二氟化氙、六氟化氙 | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
四氟化氙(化學式:XeF4)是貴氣體氙的氟化物之一,是第一個發現的貴氣體二元化合物。[2]
製造[編輯]
- 首次製備的方法:由Xe與F2以1:2摩爾比反應得到。[3][4]該反應是放熱反應,每摩爾反應放出251kJ的熱量。[2]
- 放電合成法:將氙與氟按體積比1:2加入反應容器(溫度需控制在-78℃),放電條件為1100V、31mA到2800V、12mA,反應歷時3小時。電壓不能太高否則氙與氟發生燃燒反應。為了主要獲得四氟化氙,氟需要略微過量。
- 二氟化二氮氟化法:在200℃以下將二氟化二氮與氙共熱,主要得到四氟化氙。該法可以避免使用危險且難以製備的氟單質。
物理性質[編輯]
四氟化氙是一種無色固體,室溫下易升華。四氟化氙微溶於無水氟化氫,但並不電離。它不溶於全氟庚烷中,但可溶於NOF·3HF。[5]
結構[編輯]
1963年核磁共振譜與X射線晶體學數據顯示其四氟化氙的空間構型為平面正方形。[6][7]四氟化氙為體心單斜晶系,X射線繞射法和中子繞射法測得Xe-F鍵鍵長約為190pm。
化學性質[編輯]
四氟化氙在室溫下穩定,可以長期儲存在鎳制容器中,如果去除水和氟化氫也可保存在玻璃容器中。
- 它能被氫氣還原,該反應可用於分析鑑定:
- 這個反應機理很複雜,Xe(IV)先發生歧化反應得到Xe(0)和Xe(VI),然後分別氧化水並放出氧氣。
- 它在撞擊或震動下都很穩定,不會爆炸性分解。但與有機物(例如四氫呋喃、二氧六環、丙酮、乙烯)接觸時會劇烈反應而引起燃燒。如果與氣態的乙醇或丙酮反應將發生爆炸。
- 氟磺酸中的-OSO2F是電負性很高的基團,可取代四氟化氙中的氟原子形成衍生物:
- 但後來化學家再次進行該實驗時,只得到了二氟化氙的衍生物。這可能是過去使用的四氟化氙不純造成的。[5]
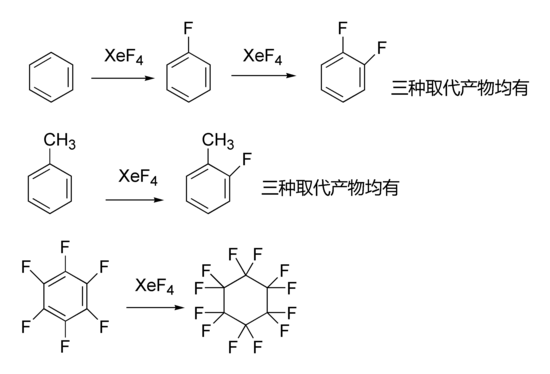
- 以下是四氟化氙參與的有機反應:
參考資料[編輯]
- ^ Holleman, Arnold F.; Wiberg, Egon. Wiberg, Nils , 編. Inorganic Chemistry. 由Eagleson, Mary; Brewer, William翻譯. Academic Press. 2001: 394. ISBN 0-12-352651-5.
- ^ 2.0 2.1 Zumdahl. Chemistry. : 243. ISBN 0-618-52844-X.
- ^ Claassen, H. H.; Selig, H.; Malm, J. G. Xenon Tetrafluoride. J. Am. Chem. Soc. 1962, 84 (18): 3593. doi:10.1021/ja00877a042.
- ^ C. L. Chernick, H. H. Claassen, P. R. Fields 1, H. H. Hyman, J. G. Malm, W. M. Manning, M. S. Matheson, L. A. Quarterman, F. Schreiner, H. H. Selig, I. Sheft, S. Siegel, E. N. Sloth, L. Stein, M. H. Studier, J. L. Weeks, and M. H. Zirin. Fluorine Compounds of Xenon and Radon. Science. 1962, 138 (3537): 136–138. PMID 17818399. doi:10.1126/science.138.3537.136.
- ^ 5.0 5.1 5.2 5.3 張青蓮. 《无机化学丛书》第一卷:稀有气体、氢、碱金属. 北京: 科學出版社. 1991年11月: P45–51. ISBN 7-03-002238-6.
- ^ Thomas H. Brown, E. B. Whipple, and Peter H. Verdier. Xenon Tetrafluoride: Fluorine-19 High-Resolution Magnetic Resonance Spectrum. Science. 1963, 140 (3563): 178. PMID 17819836. doi:10.1126/science.140.3563.178.
- ^ James A. Ibers and Walter C. Hamilton. Xenon Tetrafluoride: Crystal Structure. Science. 1963:, 139 (3550): 106–107. PMID 17798707. doi:10.1126/science.139.3550.106.
參見[編輯]
| ||||||||||||||||||||||||||||||||||||