四羰基鎳
| 四羰基鎳 | |||
|---|---|---|---|
| |||
| IUPAC名 Tetracarbonylnickel(0) | |||
| 別名 | 羰基鎳,四羰基合鎳 | ||
| 識別 | |||
| CAS號 | 13463-39-3 | ||
| PubChem | 26039 | ||
| ChemSpider | 21865021 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | AWDHUGLHGCVIEG-ARWXMKMZAJ | ||
| UN編號 | 1259 | ||
| EINECS | 236-669-2 | ||
| ChEBI | 30372 | ||
| RTECS | QR6300000 | ||
| 性質 | |||
| 化學式 | Ni(CO)4 | ||
| 摩爾質量 | 170.7 g·mol⁻¹ | ||
| 外觀 | 易流動的無色液體 | ||
| 密度 | 1.3103 g/ml (液)[1] | ||
| 熔點 | -19.3 °C[1] | ||
| 沸點 | 42.2 °C[1] | ||
| 溶解性(水) | 不溶於水,但溶於很多有機溶劑[1] | ||
| 結構 | |||
| 配位幾何 | 四面體 | ||
| 分子構型 | 四面體 | ||
| 偶極矩 | 零 | ||
| 熱力學 | |||
| ΔfHm⦵298K | -632 kJ/mol | ||
| ΔcHm⦵ | -1180 kJ/mol | ||
| S⦵298K | 320 J.K−1.mol−1 | ||
| 危險性 | |||
| 警示術語 | R:R61, R11, R26, R40, R50/53 | ||
| 安全術語 | S:S53, S45, S60, S61 | ||
| 歐盟分類 | 可燃 (F) 極毒(T+) Carc. Cat. 3 Repr. Cat. 2 對環境有害(N) | ||
| NFPA 704 | |||
| 閃點 | -20 °C | ||
| 自燃溫度 | 60 °C | ||
| 相關物質 | |||
| 相關金屬羰基配合物 | 六羰基鉻,十羰基二錳,五羰基鐵,八羰基二鈷 | ||
| 相關化學品 | 四(三苯基膦)鈀,四(三氟化磷)鎳 | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
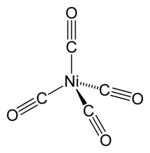
四羰基鎳,或稱羰基鎳、四羰基合鎳,是一個有機金屬配合物,分子式為Ni(CO)4。1890年首先由路德維希·蒙德(Ludwig Mond)製得,是第一個合成的簡單金屬羰基配合物。室溫下四羰基鎳為無色液體,易揮發,毒性極大。
結構[編輯]
Ni(CO)4為四面體結構,Ni原子中心與四個羰基(一氧化碳配體)相連。CO配體中C-O以三鍵相連,碳端與金屬配合。當初在弄清四羰基鎳結構時頗費了一些周折,以至於1950年前的大多數出版物都認為它由CO鏈與金屬螯合組成。
四羰基鎳與五羰基鐵和六羰基鉬等金屬羰基配合物類似,共有18個價電子,符合18電子規則。這些配合物都為對稱結構,不帶電荷,揮發性很強。四羰基鎳中鎳原子的形式氧化數為零。
製備[編輯]
1890年路德維希·蒙德通過使鎳與一氧化碳反應首先合成了Ni(CO)4。這是第一個製得的簡單金屬羰基化合物,引發了羰基配合物的合成和研究熱潮,其中重要的包括V、Cr、Mn、Fe和Co。
金屬鎳常壓下50℃即可與一氧化碳反應生成四羰基鎳。[1]蒙德法純化金屬鎳的過程為:323K下讓一氧化碳通過不純的鎳表面,化合生成四羰基鎳,再適當加熱使四羰基鎳分解為金屬,即可達到純化的目的。[2]
反應[編輯]
與其他低價金屬羰基配合物類似,Ni(CO)4可發生取代反應和氧化反應。與路易斯鹼配體如三苯基膦反應得到Ni(CO)3(PPh3)和Ni(CO)2(PPh3)2,與2,2'-聯吡啶的反應類似。
氯氣和其他鹵素可將四羰基鎳氧化為NiCl2並放出CO氣體,可用於過量四羰基鎳的銷毀。
還原四羰基鎳或用氫氧化物處理,會生成簇合物[Ni5(CO)12]2−和[Ni6(CO)12]2−。
Ni(CO)4可羰基化鹵代烷或鹵代芳烴,例如乙烯基溴化物PhCH=CHBr與四羰基鎳和甲醇鈉反應,產物是不飽和酯。此類反應可能經由Ni(CO)3中間體,再發生氧化加成反應。
金屬羰基配合物易受親核試劑進攻,以親核試劑(Nu−)處理Ni(CO)4得到酰基衍生物[Ni(CO)3C(O)Nu)]−。
毒性[編輯]
| 此章節尚無參考來源,內容或許無法查證。 |
Ni(CO)4揮發性強且毒性很大,歸咎於分解出的鎳粉與一氧化碳在體內的共同作用。皮膚接觸,尤其是吸入四羰基鎳可能是致命的,接觸30分鐘的LC50約為3ppm,立即致死濃度則為30ppm。
其蒸氣帶有腐爛和煤煙味,可以在空氣中自燃。使用四羰基鎳的實驗室常放有對其更加敏感的金絲雀,以指示四羰基鎳的濃度。
鎳中毒可分為兩個階段。第一階段內的症狀包括頭痛和心臟疼痛,可持續數小時,而後會有減輕。第二階段則發生在16小時後,為肺炎所導致的咳嗽、呼吸困難和嚴重的疲乏,四天後症狀最為嚴重,可能因為心肺和急性腎功能衰竭而導致死亡。康復所需的時間很長,期間常伴有疲憊、憂鬱症和呼吸困難等症狀。四羰基鎳造成永久呼吸損傷的例子並不常見,其致癌性也仍有爭議。
參考資料[編輯]
- Lascelles,Keith; Morgan, Lindsay G.; & Nicholls, David. Nickel Compounds. Ullmann's Encyclopedia of Industrial Chemistry. 1991, A17 (5): 235–249.
- EROS Encyclopedia of Reagents for Organic Synthesis, John Wiley & Sons, 2003.
- C. Elschenbroich, A. Salzer 」Organometallics : A Concise Introduction」 (2nd Ed) (1992) from Wiley-VCH: Weinheim. ISBN 3-527-28165-7
- Shi Z. Nickel carbonyl: toxicity and human health. The Science of The Total Environment. 1991, 148: 293-298.DOI.
- Sunderman FW. A Pilgrimage into the Archive of Nickel Toxicology. Annals of Clinical and Lalboratory Science. 1989, 19: 1–16.
- Armit HW. The toxicology of nickel carbonyl. Part II.. Journal of Hygiene. 1908, 8: 565–610.
- Armit HW. The toxicology of nickel carbonyl. Journal of Hygiene. 1907, 7: 525–551.
- Barceloux DG. Nickel. Journal of Toxicology-Clinical Toxicology. 1999, 37: 239-258.DOI.
外部連結[編輯]
- 國際化學品安全卡0064(頁面存檔備份,存於互聯網檔案館)
- 四羰基鎳資料頁
- NIOSH化學品安全(頁面存檔備份,存於互聯網檔案館)
- 歐洲化學品局
- IARC「鎳及其化合物」
- NIST數據庫(頁面存檔備份,存於互聯網檔案館)
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|