威爾金森催化劑
| 威爾金森催化劑 | |
|---|---|

| |
| |

| |

| |
| IUPAC名 (SP-4)chloridotris(triphenylphosphane) rhodium | |
| 別名 | 氯化三(三苯基膦)合銠(I) |
| 識別 | |
| CAS號 | 14694-95-2 |
| PubChem | 84599 |
| SMILES |
|
| EINECS | 238-744-5 |
| RTECS | 無 |
| 性質 | |
| 化學式 | C54H45ClP3Rh |
| 摩爾質量 | 925.22 g·mol⁻¹ |
| 外觀 | 紅色固體 |
| 熔點 | 245-250℃ |
| 溶解性(水) | 不溶於水 |
| 溶解性(其他溶劑) | 苯 |
| 結構 | |
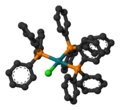
| 配位幾何 | 平面正方形 |
| 危險性 | |
| 警示術語 | R:無 |
| 安全術語 | S:S22 S24/25 |
| 主要危害 | 無 |
| 相關物質 | |
| 相關化學品 | 三苯基膦 四(三苯基膦)鈀 羰基二(三苯基膦)氯化銥 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
威爾金森催化劑(英語:Wilkinson's catalyst),即氯化三(三苯基膦)合銠(I),是由已故的英國化學家傑弗里·威爾金森爵士在1966年發現的一種金屬銠的絡合物。[1]
催化劑結構和基本性質[編輯]
威爾金森催化劑分子具有平面正方形和16個價電子。通常是由過量的三苯基膦和水合三氯化銠在乙醇中加熱回流反應製得的紫紅色晶狀固體[2][3]。過量的三苯基膦作為還原劑用於將三價的銠還原成一價銠同時生成三苯基氧化膦。
- RhCl3(H2O)3 + 4 PPh3 → RhCl(PPh3)3 + O=PPh3 + 2 HCl + 2 H2O
催化劑的應用[編輯]
威爾金森催化劑可用於烯烴的催化氫化[4][5]。反應的機理是:首先發生一個或者兩個三苯基膦配體的解離分別形成12或14個電子的絡合物,接着發生氫分子對金屬原子的氧化加成,隨後與烯烴形成Π-絡合物,之後是進行分子內的氫轉移,最後發生還原消除生成一個產物烷烴。

威爾金森催化劑的其他應用包括用於催化烯烴與兒茶酚硼烷或頻那醇硼烷的硼氫化反應[6]、催化三乙基矽氫對α,β-不飽和羰基化合物的選擇性1,4-還原[7]。將威爾金森催化劑中的兩個三苯基膦用手性的雙齒膦配體(比如Chiraphos)置換,就能得到可以將潛手性的烯烴氫化還原成手性烷烴的不對稱催化劑[8]。
威爾金森催化劑的其他反應[編輯]
RhCl(PPh3)3與一氧化碳反應得到沃什卡絡合物的類似物trans-RhCl(CO)(PPh3)2(它的反應活性遠小於沃什卡絡合物)。trans-RhCl(CO)(PPh3)2也可由威爾金森催化劑和醛發生脫羰反應得到
- RhCl(PPh3)3 + RCHO → RhCl(CO)(PPh3)2 + RH + PPh3
RhCl(PPh3)3在苯中攪拌後會發生二聚反應,析出在苯中溶解性較差的紅色Rh2Cl2(PPh3)4。
參考資料[編輯]
- ^ Osborn, J. A.; Jardine, F. H.; Young, J. F.; Wilkinson, G. The Preparation and Properties of Tris(triphenylphosphine)halogenorhodium(I) and Some Reactions Thereof Including Catalytic Homogeneous Hydrogenation of Olefins and Acetylenes and Their Derivatives. Journal of the Chemical Society A. 1966: 1711–1732. doi:10.1039/J19660001711.
- ^ Bennett, M. A.; Longstaff, P. A. Complexes of Rhodium(I) with Triphenylphosphine. Chem. Ind. (London) 1965, p.846.
- ^ Osborn, J. A.; Jardine, F. H., Young, J. F., Wilkinson, G. The preparation and properties of tris(triphenylphosphine)halogenorhodium(I) and some reactions thereof including catalytic homogeneous hydrogenation of olefins and acetylenes and their derivatives. Journal of the Chemical Society A. 1966-01-01: 1711. doi:10.1039/J19660001711.
- ^ A. J. Birch, D. H. Williamson (1976). Organic Reactions 24: 1ff
- ^ B.R. James, Homogeneous Hydrogenation. John Wiley & Sons, New York, 1973
- ^ D. A. Evans, G. C. Fu and A. H. Hoveyda. Rhodium(I)-catalyzed hydroboration of olefins. The documentation of regio- and stereochemical control in cyclic and acyclic systems. J. Am. Chem. Soc. 1988, 110: 6917–6918. doi:10.1021/ja00228a068.
- ^ I. Ojima, T. Kogure. Selective reduction of α,β-unsaturated terpene carbonyl compounds using hydrosilane-rhodium(I) complex combinations. Tetrahedron Lett. 1972, 13 (49): 5035–5038. doi:10.1016/S0040-4039(01)85162-5.
- ^ W. S. Knowles. Asymmetric Hydrogenations (Nobel Lecture 2001). Advanced Synthesis and Catalysis. 2003, 345 (12): 3–13. doi:10.1002/adsc.200390028.
| |||||||||||||||||||||||||||||||||||||
