氧化亞銅
| 氧化亞銅 | |
|---|---|

| |

| |

| |
| IUPAC名 Copper(I) oxide | |
| 別名 | 氧化銅(I) 赤銅礦 紅色氧化銅 |
| 識別 | |
| CAS號 | 1317-39-1 |
| PubChem | 10313194 |
| ChemSpider | 8488659 |
| SMILES |
|
| InChI |
|
| InChIKey | BERDEBHAJNAUOM-YQWGQOGZAF |
| EINECS | 215-270-7 |
| ChEBI | 81908 |
| RTECS | GL8050000 |
| KEGG | C18714 |
| 性質 | |
| 化學式 | Cu2O |
| 摩爾質量 | 143.09 g·mol⁻¹ |
| 外觀 | 棕紅色固體 |
| 密度 | 6.0 g/cm3 |
| 熔點 | 1232 °C(1505 K) |
| 沸點 | 1800 °C(2073 K) |
| 溶解性(水) | 不可溶 |
| 溶解性(酸) | 可溶 |
| 能隙 | 2.137 eV |
| 磁化率 | −20×10−6 cm3/mol |
| 結構 | |
| 晶體結構 | 立方 |
| 空間群 | Pn3m, |
| 晶格常數 | a = 4.2696 |
| 熱力學 | |
| ΔfHm⦵298K | −170 kJ·mol−1 |
| S⦵298K | 93 J·mol−1·K−1 |
| 危險性 | |
GHS危險性符號  
| |
| GHS提示詞 | 危險 |
| H-術語 | H302, H318, H332, H400, H410 |
| P-術語 | P273, P305+351+338[1] |
| NFPA 704 | |
| PEL | TWA 1 mg/m3 (作為Cu)[2] |
| 相關物質 | |
| 其他陰離子 | 硫化亞銅 硫化銅 硒化亞銅 |
| 其他陽離子 | 氧化銅 氧化銀 氧化鎳 氧化鋅 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
氧化亞銅是化學式為Cu2O的無機化合物。它是銅的主要氧化物之一,另一種是氧化銅(CuO)。這種紅色固體是一些抗附着漆的成分。根據顆粒的大小,該化合物可能呈現黃色或紅色。[3]氧化亞銅被發現為帶紅色的礦物赤銅礦。
製備[編輯]
氧化亞銅可以通過多種方法生產。[4]最直接的是通過銅金屬的氧化產生:
- 4 Cu + O2 = 2 Cu2O
水和酸等添加劑會影響該過程的速度以及進一步氧化為氧化銅。它還通過用二氧化硫還原銅(II)溶液進行商業生產。
反應[編輯]
氯化亞銅水溶液與鹼反應,會得到相同的物質。在所有情況下,顏色對程序的細節非常敏感。
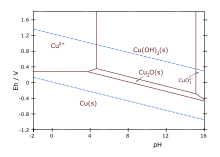
氧化亞銅的形成是斐林測試和本氏測試還原糖的基礎。這些糖還原銅(II)鹽的鹼性溶液,產生鮮紅色的Cu2O沉澱。
當銀鍍層損壞時,它會在暴露於濕氣的鍍銀銅部件上形成。這種腐蝕被稱為紅疫。
性質[編輯]
氧化亞銅固體是抗磁性的。就其配位範圍而言,銅中心是2-配位且氧化物是四面體的。因此,該結構在某種意義上類似於SiO2的主要同質異形體,並且兩種結構都具有互穿晶格的特點。
氧化亞銅在濃氨溶液中形成無色配合物[Cu(NH3)2]+,在空氣中易氧化為藍色的[Cu(NH3)4(H2O)2]2+。溶於鹽酸生成CuCl−
2,在稀硫酸和硝酸中分別產生硫酸銅和硝酸銅。[5]
Cu2O在潮濕空氣中會氧化為氧化銅。
結構[編輯]
Cu2O以立方晶系結晶,晶格常數al = 4.2696 Å。銅原子排列在fcc亞晶格中,氧原子排列在bcc亞晶格中。一個亞晶格移動了四分之一的身體對角線。空間群為Pn3m,包含全八面體對稱的點群。
半導體特性[編輯]
在半導體物理學史上,Cu2O是研究最多的材料之一,許多實驗性的半導體應用首先在這種材料中得到了證明:
Cu2O中最低的激子壽命極長;吸收線型已被證明具有NeV的線寬,這是迄今為止觀察到的最窄的體激子共振。[9]相關的四極電磁極化子具有接近聲速的低群速度。因此,光在這種介質中的移動速度幾乎與聲音一樣慢,這導致了高電磁極化子密度。基態激子的另一個不同尋常的特徵是,所有主要的散射機制都是定量的。[10]Cu2O第一個完全無參數的吸收線寬隨溫度變寬的模型的物質,從而可以推斷出相應的衰減係數。Cu2O可以證明克喇末-克勒尼希關係不適用於電磁極化子。[11]
應用[編輯]
氧化亞銅通常用作顏料、殺真菌劑和船舶塗料的防附着劑。早在1924年,在矽成為標準之前,基於這種材料的整流二極管就已在工業上使用。氧化亞銅也是本氏測試呈陽性的粉紅色的原因。
2021年12月,東芝宣佈研製出透明氧化亞銅 (Cu2O) 薄膜太陽能電池。該電池實現了8.4%的能量轉換效率,這是截至2021年任何此類電池報告的最高效率。該電池可用於高空平台站應用和電動汽車。[12]
參見[編輯]
參考資料[編輯]
- ^ https://www.nwmissouri.edu/naturalsciences/sds/c/Copper%20I%20oxide.pdf[失效連結]
- ^ NIOSH Pocket Guide to Chemical Hazards. #0150. NIOSH.
- ^ N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, 2nd ed., Butterworth-Heinemann, Oxford, UK, 1997.
- ^ H. Wayne Richardson "Copper Compounds in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a07_567
- ^ D. Nicholls, Complexes and First-Row Transition Elements, Macmillan Press, London, 1973.
- ^ L. O. Grondahl, Unidirectional current carrying device, Patent, 1927
- ^ Hanke, L.; Fröhlich, D.; Ivanov, A. L.; Littlewood, P. B.; Stolz, H. LA Phonoritons in Cu2O. Physical Review Letters. 1999-11-22, 83 (21): 4365–4368. Bibcode:1999PhRvL..83.4365H. doi:10.1103/PhysRevLett.83.4365.
- ^ L. Brillouin: Wave Propagation and Group Velocity, Academic Press, New York City, 1960 ISBN 9781483276014.
- ^ Brandt, Jan; Fröhlich, Dietmar; Sandfort, Christian; Bayer, Manfred; Stolz, Heinrich; Naka, Nobuko. Ultranarrow Optical Absorption and Two-Phonon Excitation Spectroscopy of Cu2O Paraexcitons in a High Magnetic Field. Physical Review Letters (American Physical Society (APS)). 2007-11-19, 99 (21): 217403. Bibcode:2007PhRvL..99u7403B. ISSN 0031-9007. PMID 18233254. doi:10.1103/physrevlett.99.217403.
- ^ J. P. Wolfe and A. Mysyrowicz: Excitonic Matter, Scientific American 250 (1984), No. 3, 98.
- ^ Hopfield, J. J. Theory of the Contribution of Excitons to the Complex Dielectric Constant of Crystals. Physical Review. 1958, 112 (5): 1555–1567. Bibcode:1958PhRv..112.1555H. ISSN 0031-899X. doi:10.1103/PhysRev.112.1555.
- ^ Bellini, Emiliano. Toshiba claims 8.4% efficiency for transparent cuprous oxide solar cell. pv magazine. 2021-12-22 [2021-12-22]. (原始內容存檔於2022-06-25).
外部連結[編輯]
| 維基共享資源上的相關多媒體資源:氧化亞銅 |
- National Pollutant Inventory: Copper and compounds fact sheet
- Chemical Land21 Product Information page (頁面存檔備份,存於互聯網檔案館)
- Make a solar cell in your kitchen
- A Flat Panel Solar Battery
- Copper oxides project page (頁面存檔備份,存於互聯網檔案館)
| ||||||||||||||||||||||||||||||||||||

