草酸
| 草酸 | |||
|---|---|---|---|
| |||
| |||

| |||
| IUPAC名 Oxalic acid[1] | |||
| 系統名 Ethanedioic acid[1] 乙二酸 | |||
| 別名 | 酢漿草酸 | ||
| 識別 | |||
| CAS編號 | 144-62-7(無水) 6153-56-6(二水) | ||
| PubChem | 971 | ||
| ChemSpider | 946 | ||
| SMILES |
| ||
| Beilstein | 385686 | ||
| Gmelin | 2208 | ||
| 3DMet | B00059 | ||
| UN編號 | 3261 | ||
| EINECS | 205-634-3 | ||
| ChEBI | 16995 | ||
| RTECS | RO2450000 | ||
| DrugBank | DB03902 | ||
| KEGG | C00209 | ||
| MeSH | Oxalic+acid | ||
| 性質 | |||
| 化學式 | H2C2O4(無水) C2H2O4·2H2O(二水) | ||
| 摩爾質量 | (無水)90.03 g/mol (二水)126.07 g·mol⁻¹ | ||
| 外觀 | 白色晶體 | ||
| 密度 | 1.90 g/cm³(無水) 1.653 g/cm³(二水) | ||
| 熔點 | 101-102 °C(二水) | ||
| 溶解性(水) | 9.5 g/100 mL(15 °C) 14.3 g /100 mL(25 °C?) 120 g/100 mL(100 °C) | ||
| pKa1 | 1.38 | ||
| pKa2 | 4.28 | ||
| 熱力學 | |||
| S⦵298K | 109.8 J·mol−1·K−1 | ||
| 熱容 | 91.0 J·mol−1·K−1 | ||
| 危險性 | |||
GHS危險性符號 
| |||
| H-術語 | H302+312, H318, H402 | ||
| P-術語 | P264, P270, P273, P280, P302+352+312, P305+351+338+310, P362+364, P501 | ||
| 主要危害 | 腐蝕性 | ||
| NFPA 704 | |||
| PEL | TWA 1 mg/m3[2] | ||
| 致死量或濃度: | |||
LDLo(最低)
|
1000 mg/kg(犬,口服) 1400 mg/kg(大鼠) 7500 mg/kg(大鼠,口服)[3] | ||
| 相關物質 | |||
| 相關化學品 | |||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
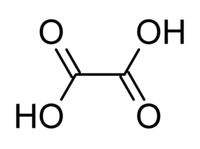
草酸(英語:Oxalic acid),也稱酢漿草酸,IUPAC系統名為乙二酸,化學式為HO
2C–CO
2H。它是最簡單的二羧酸。它是一種白色結晶固體,溶於水中形成無色溶液。它的名字來源於早期研究人員從酢漿草屬的開花植物中分離,通常為酢漿草。它天然存在於許多食物中,但過量攝入草酸或長時間皮膚接觸可能是危險的。
草酸的酸性比乙酸強得多,同時它是一種還原劑[4]。其共軛鹼稱為草酸鹽(C
2O2−
4),是一種金屬陽離子的螯合劑。草酸一般以二水合物(C
2H
2O
4 · 2H2O)的形式存在。
製備[編輯]
草酸主要是在五氧化二釩的存在下,用硝酸或空氣將碳水化合物或葡萄糖氧化製得。可以使用多種前體,包括乙醇酸和乙二醇。[5]一種較新的方法需要對醇進行氧化羰基化以產生草酸二酯:
這些草酸二酯隨後水解成草酸。每年大約生產120000噸。[6]
歷史上,草酸僅通過對木糠使用苛性鹼(如氫氧化鈉或氫氧化鉀),然後用無機酸(例如硫酸)酸化草酸鹽來獲得。[7]草酸也可以通過在鹼性催化劑存在下加熱甲酸鈉形成。[8]
實驗室方法[編輯]
雖然很容易買到,但可以在實驗室中通過在少量五氧化二釩作為催化劑存在下使用硝酸氧化蔗糖來製備草酸。[9]
在荷蘭開發的一種銅絡合物的電催化作用有助於將二氧化碳還原成草酸,[11]這種轉化以二氧化碳為原料生成草酸。
結構[編輯]
無水物[編輯]
無水草酸有兩種多形體;其中一種的氫鍵形成了鏈狀結構,而另一種形式的氫鍵模式則確定了片狀結構。[12]由於無水材料既是酸性又是親水性的(尋求水),因此可用於酯化反應。
二水合物[編輯]
二水合物(H
2C
2O
4.2H
2O)具有空間群C52h–P21/n,晶格參數a = 611.9 pm, b = 360.7 pm,c = 1205.7 pm,β = 106°19',Z = 2。[13]主要的原子間距離是:C−C 153 pm,C−O1 129 pm,C−O2 119 pm。[14]
理論研究表明,二水合草酸是極少數表現出負面積壓縮性的結晶物質之一。即當受到各向同性拉伸應力(負壓)時,a和c的晶格參數隨着應力的降低而增加,分別從-1.17GPa到-0.12GPa和從-1.17GPa到-0.51GPa。[15]
化學性質[編輯]
酸鹼性[編輯]
文獻中草酸的pKa值在1.25–1.46和3.81–4.40之間變化。[16][17][18] 2019年發佈的第100版CRC的值為1.25和3.81。[19] 與其他羧酸相比,草酸相對強:
草酸會發生許多其他羧酸所特有的反應。它會形成酯類,如草酸二甲酯(熔點52.5-53.5°C)[20]它會形成一種稱為草酰氯的酸性氯化物。
配位性[編輯]
過渡金屬離子草酸鹽配合物很多,例如藥物奧沙利鉑。草酸已被證明可以減少錳礦石中的二氧化錳(MnO
2),以便用硫酸浸出。
草酸是鑭系元素化學中的重要試劑。水合鑭系元素草酸鹽在強酸性溶液中很容易形成緻密結晶、易於過濾的形式,基本上不受非鑭系元素的污染:
- 2 Ln3+ + 3 C2O4H2 → Ln2(C2O4)3 + 6 H+
這些草酸鹽的熱分解會產生對應氧化物,也是這些元素最常見的市售形式。[21]
其他[編輯]
草酸蒸氣在125–175°C時分解成二氧化碳(CO
2)和甲酸(HCOOH)。使用237–313nm紫外光進行光解也會產生一氧化碳(CO)和水。[22]
以2:1的摩爾比蒸發尿素和草酸的溶液會產生一種固體結晶化合物H
2C
2O
4.[CO(NH
2)
2]
2,由中性分子的二維網絡堆疊組成,通過與氧原子的氫鍵結合在一起。[23]
產生[編輯]
生物合成[編輯]
酶介導的草酸鹽形成至少存在兩種途徑。在一個途徑中,草酰乙酸作為檸檬酸循環的一種成分, 被草酰乙酸酶水解成草酸和乙酸: [24]
存在於食物和植物中[編輯]

早期的研究人員從酢漿草(Oxalis)中分離出草酸。菠菜科和蕓薹屬植物(捲心菜、西蘭花、球芽甘藍等),以及酢漿草科和傘形科植物(如歐芹)的草酸鹽含量很高。[25]藜屬和莧科相關屬的所有物種的葉子和莖都含有高水平的草酸,其中包括藜麥。[26]大黃葉含約0.5%的草酸,天南星(Arisaema triphyllum)含有草酸鈣晶體。同樣,五葉地錦是一種常見的裝飾性藤本植物,在其漿果中會產生草酸,並在樹液中以針晶的形式產生草酸晶體。細菌通過碳水化合物的氧化產生草酸鹽。[6]
窗玉屬植物會產生由結晶草酸製成的光導纖維,用於將光傳輸到地下光合作用場所。[27]
楊桃也含有草酸和楊桃毒素。柑橘汁含有少量的草酸。有機農業生產的柑橘類水果比傳統農業生產的水果含有較少的草酸。[28]
在某些石灰石和大理石雕像和紀念碑上形成的天然草酸鈣斑,被認為是由碳酸鹽石頭與地衣或其他微生物分泌的草酸發生化學反應造成的。[29][30]
真菌生產[編輯]
許多土壤真菌物種分泌草酸,會導致金屬陽離子的溶解度更大,某些土壤養分的可用性增加,並可能導致草酸鈣晶體的形成。[31][32] 一些真菌如黑麴黴已被廣泛研究用於草酸的工業生產;[33]但這些工藝在經濟上與石油和天然氣生產相比還沒有競爭力。[34]
生物化學[編輯]
草酸的共軛鹼是草酸氫根陰離子,其共軛鹼(草酸鹽)是乳酸脫氫酶(LDH)的競爭性抑制劑。[35]LDH催化丙酮酸轉化為乳酸(發酵(厭氧)過程的最終產品),同時將輔酶NADH氧化為NAD+和H+。恢復NAD+水平對繼續通過糖酵解進行無氧能量代謝至關重要。由於癌細胞優先使用無氧代謝(見瓦氏效應),抑制LDH已被證明可以抑制腫瘤的形成和生長,[36]因此是癌症治療的一個有趣的潛在過程。
草酸在病原真菌和植物之間的互動中起着關鍵作用。少量的草酸可以增強植物對真菌的抵抗力,但較高的草酸會導致植物廣泛的程序性細胞死亡並有助於真菌感染。植物通常會產生少量的草酸,但一些病原真菌,如核盤菌(Sclerotinia sclerotiorum)會造成有毒的積累。[37]
草酸鹽除了被生物合成外,也可以被生物降解。產甲酸草酸桿菌(Oxalobacter formigenes)是一種重要的腸道細菌,可以幫助動物(包括人類)降解草酸鹽。[38]
用途[編輯]
草酸的主要應用包括清潔或漂白,尤其是除鏽(鐵的絡合劑)。它在除鏽劑中的用途是由於它與鐵離子形成穩定的水溶性鹽,即三草酸合鐵離子。草酸是一些牙齒美白產品的成分。生產的草酸中約有25%將用作染色過程中的媒染劑。它還用於紙漿用木材的漂白劑,鐵鏽污染消除劑,發酵粉[6]和作為矽分析儀器的第三種試劑。

草酸稀溶液(0.05–0.15M)可用於從粘土(如高嶺石)中去除鐵,以生產淺色陶瓷器。[40]
草酸有時被用於鋁陽極氧化工藝中,可以使用或不使用硫酸。[43]與硫酸陽極氧化相比,獲得的塗層更薄,表面粗糙度更低。
半導體產業[編輯]
草酸也用於電子和半導體工業。據報道,2006年它被用於半導體器件製造過程中銅層的化學機械平坦化。[44]
毒性[編輯]
草酸的LD50約為375mg/kg(以大鼠計),[45]口服的LDLo約為600mg/kg。[46][47]草酸的毒性是由於固體草酸鈣沉澱引起的腎功能衰竭。[48]
攝入乙二醇會代謝出草酸,也可導致急性腎功能衰竭。
76%的腎結石由草酸鈣組成。草酸可通過在關節中形成沉澱物而引起關節疼痛。氫氧化鈣可降低人和大鼠的尿草酸。[50]
參考資料[編輯]
- ^ 1.0 1.1 Front Matter. Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014: P001–P004. ISBN 978-0-85404-182-4. doi:10.1039/9781849733069-FP001.
- ^ NIOSH Pocket Guide to Chemical Hazards. #0474. NIOSH.
- ^ Oxalic acid. Immediately Dangerous to Life and Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ Ullmann's Encyclopedia of Industrial Chemistry. Wiley. 2005: 17624/28029. ISBN 9783527306732. doi:10.1002/14356007.
- ^ Eiichi, Yonemitsu; Tomiya, Isshiki; Tsuyoshi, Suzuki and Yukio, Yashima "Process for the production of oxalic acid", 美國專利第3,678,107號, priority date March 15, 1969
- ^ 6.0 6.1 6.2 Wilhelm Riemenschneider, Minoru Tanifuji "Oxalic acid" in Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim. doi: 10.1002/14356007.a18_247.
- ^ Von Wagner, Rudolf. Manual of chemical technology. New York: D. Appleton & Co. 1897: 499 [2022-08-31]. (原始內容存檔於2022-10-20).
- ^ Oxalic acid | Formula, Uses, & Facts | Britannica. [2022-08-31]. (原始內容存檔於2022-11-22).
- ^ Practical Organic Chemistry by Julius B. Cohen, 1930 ed. preparation #42
- ^ Clarke H. T.;. Davis, A. W. (1941). "Oxalic acid (anhydrous)". Org. Synth.: 421; Coll. Vol. 1.
- ^ Bouwman, Elisabeth; Angamuthu, Raja; Byers, Philip; Lutz, Martin; Spek, Anthony L. Electrocatalytic CO2 Conversion to Oxalate by a Copper Complex. Science. July 15, 2010, 327 (5393): 313–315. Bibcode:2010Sci...327..313A. CiteSeerX 10.1.1.1009.2076
 . PMID 20075248. S2CID 24938351. doi:10.1126/science.1177981.
. PMID 20075248. S2CID 24938351. doi:10.1126/science.1177981.
- ^ Wells, A.F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press. ISBN 0-19-855370-6.
- ^ T. M. Sabine, G. W. Cox and B. M. Craven (1969): "A neutron diffraction study of [alpha]-oxalic acid dihydrate" Acta Crystallographica Section B, volume B25, pages 2437-2441. doi:10.1107/S0567740869005905
- ^ F. R. Ahmed and D. W. J. Cruickshank (1953): "A refinement of the crystal structure analyses of oxalic acid dihydrate". Acta Crystallographica volume 6, pages 385-392. doi:10.1107/S0365110X53001083
- ^ Francisco Colmenero (2019): "Negative area compressibility in oxalic acid dihydrate". Materials Letters, volume 245, pages 25-28. doi:10.1016/j.matlet.2019.02.077
- ^ Bjerrum, J., et al. (1958) Stability Constants, Chemical Society, London.
- ^ Haynes, W. M. (Ed.). (2014). CRC Handbook of Chemistry and Physics, 95th Edition (95 edition). Boca Raton; London; New York: CRC Press.
- ^ Clayton, G. D. and Clayton, F. E. (eds.). Patty's Industrial Hygiene and Toxicology, Volume 2A, 2B, 2C: Toxicology. 3rd ed. New York: John Wiley Sons, 1981–1982., p. 4936
- ^ Rumble, J. (Ed.). (2019). CRC Handbook of Chemistry and Physics, 100th Edition (100 edition). CRC Press.
- ^ Bowden, E. (1943). "Methyl oxalate". Org. Synth.: 414; Coll. Vol. 2.
- ^ DezhiQi. Extraction of Rare Earths From RE Concentrates. Hydrometallurgy of Rare Earths Separation and Extraction. 2018: 1-185. ISBN 9780128139202. doi:10.1016/B978-0-12-813920-2.00001-5.
- ^ James Higgins, Xuefeng Zhou, Ruifeng Liu, and Thomas T.-S. Huang (1997): "Theoretical Study of Thermal Decomposition Mechanism of Oxalic Acid" Journal of Physical Chemistry A, volume 101, issue 14, pages 2702–2708. doi:10.1021/jp9638191
- ^ S. Harkema, J. W. Bats, A. M. Weyenberg and D. Feil (1972) "The crystal structure of urea oxalic acid (2:1)". Acta Crystallographica Section B, volume B28, pages 1646-1648. doi:10.1107/S0567740872004789
- ^ Dutton, M. V.; Evans, C. S. Oxalate production by fungi: Its role in pathogenicity and ecology in the soil environment. Canadian Journal of Microbiology. 1996, 42 (9): 881–895. doi:10.1139/m96-114..
- ^ Rombauer, Rombauer Becker, and Becker (1931/1997). Joy of Cooking, p.415. ISBN 0-684-81870-1.
- ^ Siener, Roswitha; Honow, Ruth; Seidler, Ana; Voss, Susanne; Hesse, Albrecht. Oxalate contents of species of the Polygonaceae, Amaranthaceae, and Chenopodiaceae families. Food Chemistry. 2006, 98 (2): 220–224. doi:10.1016/j.foodchem.2005.05.059.
- ^ Attenborough, David. "Surviving." The Private Life of Plants: A Natural History of Plant Behaviour. Princeton, NJ: Princeton UP, 1995. 265+. "OpenLibrary.org: The Private Life of Plants" (頁面存檔備份,存於互聯網檔案館) Print.
- ^ Duarte, A.; Caixeirinho, D.; Miguel, M.; Sustelo, V.; Nunes, C.; Fernandes, M.; Marreiros, A. Organic Acids Concentration in Citrus Juice from Conventional versus Organic Farming. Acta Horticulturae. 2012, 933 (933): 601–606. doi:10.17660/ActaHortic.2012.933.78. hdl:10400.1/2790
 .
.
- ^ Sabbioni, Cristina; Zappia, Giuseppe. Oxalate patinas on ancient monuments: The biological hypothesis. Aerobiologia. 2016, 7: 31–37. S2CID 85017563. doi:10.1007/BF02450015.
- ^ Frank-Kamemetskaya, Olga; Rusakov, Alexey; Barinova, Ekaterina; Zelenskaya, Marina; Vlasov, Dmitrij. The Formation of Oxalate Patina on the Surface of Carbonate Rocks Under the Influence of Microorganisms. Proceedings of the 10th International Congress for Applied Mineralogy (ICAM). 2012: 213–220. ISBN 978-3-642-27681-1. doi:10.1007/978-3-642-27682-8_27.
- ^ Dutton, Martin V.; Evans, Christine S. Oxalate production by fungi: its role in pathogenicity and ecology in the soil environment. Canadian Journal of Microbiology. 1 September 1996, 42 (9): 881–895. doi:10.1139/m96-114.
- ^ Gadd, Geoffrey M. Fungal Production of Citric and Oxalic Acid: Importance in Metal Speciation, Physiology and Biogeochemical Processes. Advances in Microbial Physiology (Academic Press). 1 January 1999, 41: 47–92. ISBN 9780120277414. PMID 10500844. doi:10.1016/S0065-2911(08)60165-4 (英語).
- ^ Hermann Strasser, Wolfgang Burgstaller, Franz Schinner(1994): "High-yield production of oxalic acid for metal leaching processes by Aspergillus niger". FEMS Microbiology Letters, volume 119, issue 3, pages 365–370. doi:10.1111/j.1574-6968.1994.tb06914.x
- ^ Jan S. Tkacz, Lene Lange (2012): Advances in Fungal Biotechnology for Industry, Agriculture, and Medicine. 445 pages. ISBN 9781441988591
- ^ Novoa, William; Alfred Winer; Andrew Glaid; George Schwert. Lactic Dehydrogenase V. inhibition by Oxamate and Oxalate. Journal of Biological Chemistry. 1958, 234 (5): 1143–8. PMID 13654335. doi:10.1016/S0021-9258(18)98146-9
 .
.
- ^ Le, Anne; Charles Cooper; Arvin Gouw; Ramani Dinavahi; Anirban Maitra; Lorraine Deck; Robert Royer; David Vander Jagt; Gregg Semenza; Chi Dang. Inhibition of lactate dehydrogenase A induces oxidative stress and inhibits tumor progression. Proceedings of the National Academy of Sciences. 14 December 2009, 107 (5): 2037–2042. PMC 2836706
 . PMID 20133848. doi:10.1073/pnas.0914433107
. PMID 20133848. doi:10.1073/pnas.0914433107  .
.
- ^ Lehner, A; Meimoun, P; Errakhi, R; Madiona, K; Barakate, M; Bouteau, F. Toxic and signalling effects of oxalic acid: Oxalic acid-Natural born killer or natural born protector?. Plant Signaling & Behavior. September 2008, 3 (9): 746–8. PMC 2634576
 . PMID 19704845. doi:10.4161/psb.3.9.6634.
. PMID 19704845. doi:10.4161/psb.3.9.6634.
- ^ Daniel SL, Moradi L, Paiste H, Wood KD, Assimos DG, Holmes RP, et al. Julia Pettinari M , 編. Forty Years of Oxalobacter formigenes, a Gutsy Oxalate-Degrading Specialist. Applied and Environmental Microbiology. August 2021, 87 (18): e0054421. Bibcode:2021ApEnM..87E.544D. PMC 8388816
 . PMID 34190610. doi:10.1128/AEM.00544-21.
. PMID 34190610. doi:10.1128/AEM.00544-21.
- ^ Yu-Lun Lisa Fu. Exploring New Methods for Varroa Mite Control. Michigan State University. 2008.
- ^ Sung Oh Lee, Tam Tran, Byoung Hi Jung, Seong Jun Kim, and Myong Jun Kim (2007): "Dissolution of iron oxide using oxalic acid". Hydrometallurgy, volume 87, issues 3–4. pages 91-99. doi:10.1016/j.hydromet.2007.02.005
- ^ Jackson, Faith. "Quartz Crystal Cleaning" 互聯網檔案館的存檔,存檔日期2013-10-29.. bluemooncrystals.com
- ^ "Rock Currier – Cleaning Quartz" (頁面存檔備份,存於互聯網檔案館). mindat.org
- ^ Keshavarz, A., Parang, Z. & Nasseri, A. The effect of sulfuric acid, oxalic acid, and their combination on the size and regularity of the porous alumina by anodization. J Nanostruct Chem 3, 34 (2013). https://doi.org/10.1186/2193-8865-3-34
- ^ Lowalekar, Viral Pradeep. Oxalic Acid Based Chemical Systems for Electrochemical Mechanical Planarization of Copper. UA Campus Repository (University of Arizona). 2006 [2022-08-31]. Bibcode:2006PhDT........96L. (原始內容存檔於2021-07-29) (英語).
- ^ Rhurbarb poisoning on rhurbabinfo.com. [2010-01-12]. (原始內容存檔於2008-10-16).
- ^ Oxalic Acid Material Safety Data Sheet (PDF). Radiant Indus Chem. [2014-05-20]. (原始內容 (PDF)存檔於2014-05-20).
- ^ Safety Officer in Physical Chemistry. Safety (MSDS) data for oxalic acid dihydrate. 牛津大學出版社. 2005-08-13 [2009-12-03]. (原始內容存檔於2010-01-07).
- ^ EMEA Committee for veterinary medicinal products, oxalic acid summary report, December 2003[失效連結]
- ^ Patel, Mikita; Yarlagadda, Vidhush; Adedoyin, Oreoluwa; Saini, Vikram; Assimos, Dean G.; Holmes, Ross P.; Mitchell, Tanecia. Oxalate induces mitochondrial dysfunction and disrupts redox homeostasis in a human monocyte derived cell line. Redox Biology. May 2018, 15: 207–215. PMC 5975227
 . PMID 29272854. doi:10.1016/j.redox.2017.12.003.
. PMID 29272854. doi:10.1016/j.redox.2017.12.003.
- ^ Rajagopal, G.; Toora, B. D.; Sivakamasundari, R. I. Effect of addition of calcium hydroxide to foods rich in oxalic acid on calcium and oxalic acid metabolism. Biomedicine. 10 August 2004, 24 (3–4): 32–35.
外部連結[編輯]
| 維基共享資源中相關的多媒體資源:草酸 |
- Oxalic acid MS Spectrum(頁面存檔備份,存於互聯網檔案館)
- 國際化學品安全卡0529
- NIOSH Guide to Chemical Hazards (CDC)(頁面存檔備份,存於互聯網檔案館)
- Table: Oxalic acid content of selected vegetables (USDA)
- Alternative link: Table: Oxalic Acid Content of Selected Vegetables (USDA)(頁面存檔備份,存於互聯網檔案館)
- About rhubarb poisoning (The Rhubarb Compendium)
- Oxalosis & Hyperoxaluria Foundation (OHF) The Oxalate Content of Food 2008 (PDF)
- Oxalosis & Hyperoxaluria Foundation (OHF) Diet Information
- Calculator: Water and solute activities in aqueous oxalic acid(頁面存檔備份,存於互聯網檔案館)
| ||||||||||||||||||||||
| ||||||||||||



