八羰基二钴
| 八羰基二钴 | |
|---|---|
| |

| |

| |
| IUPAC名 Octacarbonyldicobalt(Co—Co) | |
| 识别 | |
| CAS号 | 10210-68-1 |
| PubChem | 25049 |
| ChemSpider | 2007057 |
| SMILES |
|
| InChI |
|
| InChIKey | MQIKJSYMMJWAMP-UHFFFAOYAG |
| UN编号 | 3281 |
| EINECS | 233-514-0 |
| RTECS | GG0300000 |
| 性质 | |
| 化学式 | Co2(CO)8 |
| 摩尔质量 | 341.95 g·mol⁻¹ |
| 外观 | 橙色晶体[1] |
| 密度 | 1.78 g/cm3[1] |
| 熔点 | 52 °C(325 K)(分解[1]) |
| 溶解性(水) | 不溶[1] |
| 蒸气压 | 0.7 mmHg (20 °C)[2] |
| 结构 | |
| 偶极矩 | 1.33 D(C2v异构体) 0 D(D3d异构体) |
| 危险性 | |
| MSDS | External SDS |
GHS危险性符号   
| |
| GHS提示词 | Danger |
| H-术语 | H251, H302, H304, H315, H317, H330, H351, H361, H412 |
| P-术语 | P201, P260, P273, P280, P304+340+310, P403+233 |
| 主要危害 | 可能致癌 |
| NFPA 704 | |
| 闪点 | −23 °C(−9 °F)[2] |
| PEL | 无[2] |
| 致死量或浓度: | |
LD50(中位剂量)
|
15 mg/kg(大鼠,口服) |
| 相关物质 | |
| 相关金属羰基配合物 | 五羰基铁 九羰基二铁 四羰基镍 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
八羰基二钴是一种无机化合物,化学式为Co2(CO)8。这种金属羰基配合物是金属有机化学和有机合成中的试剂及催化剂,也是有机钴化学的中心[3][4]它被用于羰基合成,也就是将烯烃转化成醛的催化剂。[5]
合成、结构与性质[编辑]
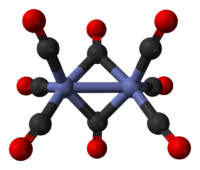
在氰化物存在条件下,通过钴(II)盐的高压羰基化反应可制得八羰基二钴。它是一种橙色易自燃的固体,对热不稳定。它在溶液中存在两种异构体[3][4],快速转化:[6]
它的优势异构体类似于Fe2(CO)9,只是少了一个桥连的羰基配体。Co-Co键的键长是2.52 Å,Co-CO端基和Co-CO桥连键长分别是1.80和1.90 Å。[7]这些异构体互变速度很快。占少数的这种异构体没有桥连的CO配体,可以写成(CO)4Co-Co(CO)4(D3d 对称群)。优势异构体中有两个桥连的CO配体,特点是含有八面体配位的钴,它可写成(CO)3Co(μ-CO)2Co(CO)3(C2v 对称群)。较少的这种异构体已经通过与C60共结晶制得。[8]
反应[编辑]
还原[编辑]
八羰基二钴可和碱金属和相关试剂(如钠汞齐)反应,生成四羰基钴酸盐,后者和酸反应生成四羰基钴酸:[4]
- Co
2(CO)
8 + 2 Na → 2 Na[Co(CO)
4] - Na[Co(CO)
4] + H+
→ H[Co(CO)
4] + Na+
和亲电试剂的反应[编辑]
八羰基二钴和卤素反应,生成四羰基卤化钴:[9]
- Co
2(CO)
8 + Br
2 → 2 Br[Co(CO)
4]
- Co
2(CO)
8 + 2 NO → 2 Co(CO)
3NO + 2 CO
合成其它羰基配合物[编辑]
加热八羰基二钴将导致脱羰基反应,并形成四面体的原子簇化合物十二羰基四钴:[4][11]
- 2 Co2(CO)8 → Co4(CO)12 + 4 CO
八羰基二钴和其它金属羰基配合物一样,可以和卤代烃反应。它和溴仿反应,生成甲爪基九羰基三钴 HCCo
3(CO)
9:[12]
- 9 Co
2(CO)
8 + 4 CHBr
3 → 4 HCCo
3(CO)
9 + 36 CO + 6 CoBr
2
其它[编辑]
CO配体可以被三烃基膦配体取代,产生Co2(CO)8-x(PR3)x。这些体积庞大的衍生物是氢甲酰化反应选择性更高的催化剂。“硬碱”,例如吡啶,可使八羰基二钴发生歧化反应:
- 6 C6H5N + 1.5 Co2(CO)8 → [Co(C6H5N)6][Co(CO)4]2 + 4 CO
Co2(CO)8也能催化葆森–侃德反应(Pauson–Khand reaction),也就是烯烃、炔烃与CO反应产生α,β-环戊烯酮衍生物的反应。
安全[编辑]
Co2(CO)8是一种挥发性的钴(0)化合物,容易自燃。它受热分解产生一氧化碳气体。 [13]
参见[编辑]
参考资料[编辑]
- ^ 1.0 1.1 1.2 1.3 Record of Dicobaltoctacarbonyl in the GESTIS Substance Database from the IFA
- ^ 2.0 2.1 2.2 NIOSH Pocket Guide to Chemical Hazards. #0147. NIOSH.
- ^ 3.0 3.1 Pauson, Peter L.; Stambuli, James P.; Chou, Teh-Chang; Hong, Bor-Cherng. Octacarbonyldicobalt. Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons: 1–26. 2014. ISBN 9780470842898. doi:10.1002/047084289X.ro001.pub3.
- ^ 4.0 4.1 4.2 4.3 Donaldson, John Dallas; Beyersmann, Detmar. Cobalt and Cobalt Compounds. Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH. 2005. ISBN 3527306730. doi:10.1002/14356007.a07_281.pub2.
- ^ Elschenbroich, C.; Salzer, A. Organometallics: A Concise Introduction 2nd. Weinheim: Wiley-VCH. 1992. ISBN 3-527-28165-7.
- ^ Sweany, Ray L.; Brown, Theodore L. Infrared spectra of matrix-isolated dicobalt octacarbonyl. Evidence for the third isomer. Inorganic Chemistry. 1977, 16 (2): 415–421. doi:10.1021/ic50168a037.
- ^ Sumner, G. G.; Klug, H. P.; Alexander, L. E. The crystal structure of dicobalt octacarbonyl. Acta Crystallographica (International Union of Crystallography (IUCr)). 1964-06-01, 17 (6): 732–742. ISSN 0365-110X. doi:10.1107/s0365110x64001803.
- ^ Garcia, Thelma Y.; Fettinger, James C.; Olmstead, Marilyn M.; Balch, Alan L. Splendid symmetry: crystallization of an unbridged isomer of Co2(CO)8 in Co2(CO)8·C60. Chemical Communications (Royal Society of Chemistry (RSC)). 2009, (46): 7143. ISSN 1359-7345. doi:10.1039/b915083h.
- ^ Winzenburg, Mark Leo. Synthesis and reactivity of transition metal carbonylates. 1979. OCLC 6572244.
- ^ King, R. B. "Organometallic Synthesis, Volume 1: Transition-metal compounds" (1965) Academic Press. ISBN 0124080502
- ^ Chini, P. The closed metal carbonyl clusters. Inorganica Chimica Acta Reviews. 1968, 2: 31–51. doi:10.1016/0073-8085(68)80013-0.
- ^ Nestle, Mara O.; Hallgren, John E.; Seyferth, Dietmar; Dawson, Peter; Robinson, Brian H. μ3-Methylidyne and μ3-Benzylidyne-Tris(Tricarbonylcobalt). Inorganic Syntheses 20. 1980: 226–229. ISBN 9780470132517. doi:10.1002/9780470132517.ch53.
- ^ Cole Parmer MSDS. [2011-07-09]. (原始内容存档于2011-09-27).
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


