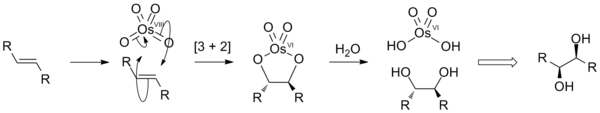四氧化锇
| 四氧化锇 | |||
|---|---|---|---|
| |||

| |||
| IUPAC名 Osmium tetraoxide | |||
| 识别 | |||
| CAS号 | 20816-12-0 | ||
| PubChem | 30318 56370778((monopotassiate)) 75811001((monoquinuclidiniate)) 53113021((monotemediate)) | ||
| ChemSpider | 28158 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | VUVGYHUDAICLFK-UHFFFAOYSA-N | ||
| UN编号 | UN 2471 | ||
| EINECS | 244-058-7 | ||
| ChEBI | 88215 | ||
| RTECS | RN1140000 | ||
| MeSH | Osmium+tetroxide | ||
| 性质 | |||
| 化学式 | OsO4 | ||
| 摩尔质量 | 254.23 g·mol⁻¹ | ||
| 外观 | 无色或浅黄色半透明固体 | ||
| 密度 | 4.9 g/cm³ (固) | ||
| 熔点 | 40.25 °C | ||
| 沸点 | 130 °C | ||
| 危险性 | |||
| 欧盟危险性符号 | |||
| 警示术语 | R:R26/27/28, R34 | ||
| 安全术语 | S:S1/2, S7/9, S26, S45 | ||
| NFPA 704 | |||
| 相关物质 | |||
| 其他阳离子 | 四氧化钌、二氧化锇 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
四氧化锇,又称氧化锇(VIII),是化学式为OsO4的化合物,常温下为无色固体,但大多数样本呈现黄褐色[1],可能是由于其中存在棕黄色二氧化锇(OsO2)杂质所致。[2]四氧化锇具有一些不同于大多数金属氧化物的特殊性质,例如具有挥发性和高毒性。
尽管四氧化锇有剧毒且锇元素罕见且昂贵,该化合物仍有很多用途,例如其与脂质结合的特性使其在生物学中广泛用作电子显微镜样本的染色剂。
物理性质[编辑]
纯四氧化锇是无色的,但因通常混有少量二氧化锇(OsO2)而呈黄褐色。OsO4可溶于四氯化碳(CCl4),微溶于水,与水反应生成锇酸(见下文)。OsO4具有挥发性,常温下易升华。气味与臭氧相似。锇的名称即起源于希腊文的“osme”,意思是“臭味”。[3]
| 溶剂 | 溶解度 | 温度(℃) |
|---|---|---|
| 水 | 7.24 | 25 |
| 四氯化碳 | 250 | 20 |
结构和电子排布[编辑]
锇(VIII)是d0金属离子,因此当Os(VIII)的配位数为四时,其形状应是四面体构型。还有MnO4−和CrO42−也是四面体构型。
OsO4中锇的化合价为+8,这是过渡金属的最高化合价。锇原子有8个价电子。如果假设每个Os-O键都提供两个电子,则该络合物总共有16个电子,与高锰酸根离子和铬酸根离子一样。
合成[编辑]
粉末状的锇在常温下与O2缓慢反应,生成OsO4。块状的锇则须加热至670 K才能被氧气氧化。[5]
- Os + 2 O2 → OsO4
反应[编辑]
氧氟化物[编辑]
- 锇有很多种氧氟化物,都对潮湿非常敏感。
在77K的低温下,四氧化锇与二氟化氪在氢氟酸溶液中反应,生成紫色的 顺式-OsO2F4。[6]
- OsO4 + 2 KrF2 → cis-OsO2F4 + 2 Kr + O2
- OsO4与F2反应,生成黄色的OsO3F2:
- 2 OsO4 + 2 F2 → 2 OsO3F2 + O2
- OsO4在常温下与等摩尔的[Me4N]F反应,在253K的温度下则与两倍的物质的量的[Me4N]F反应:[5]:
- OsO4 + [Me4N]F → [Me4N][OsO4F]
- OsO4 + 2 [Me4N]F → [Me4N]2[cis-OsO4F2]
烯烃的氧化[编辑]
- OsO4能催化烯烃与过氧化氢水溶液之间的反应。化学方程式为:
- R2C=CR2 + H2O2 → R2C(OH)-C(OH)R2.
反应中OsVIIIO4先与烯烃R2C=CR2发生加成反应,生成环"酯" R4C2O2OsVIO2,然后再水解,生成二醇和六价锇化合物(OsVI)[来源请求]:
其它反应[编辑]
- OsO4溶于碱溶液,生成高锇酸盐并分解得到锇(VI)酸盐:
- OsO4 + 2 NaOH → Na2[cis-OsO4(OH)2]
- Na2[cis-OsO4(OH)2]+H2O→Na2[OsO2(OH)4]+½O2
- OsO4 + NH3 + KOH → K[Os(N)O3] + 2 H2O
[Os(N)O3]−离子是OsO4的等电子体,且结构相同。与伯胺t-BuNH2[(CH3)3C-NH2]反应得到相应的亚氨基化合物:
- OsO4 + 4 Me3CNH2 → Os(NCMe3)4 + 4 H2O
- 在400K和200个大气压下,OsO4在甲醇溶液中与一氧化碳发生"还原性羰基化反应",生成三角形的Os3(CO)12:
此反应中锇的化合价从+8下降到0。
- 四氧化锇也可以被碳还原:
- OsO4 + 2 C → Os + 2 CO2[4]
用途[编辑]
有机合成[编辑]

在有机合成领域中,OsO4广泛用作把烯烃顺式氧化成邻二醇的氧化剂。参见以上反应机理。此反应既可以是催化反应(厄普约翰双羟基化反应、勒米厄-约翰逊氧化反应),也可以是不对称反应(夏普莱斯不对称双羟基化反应)。
生物染色[编辑]
OsO4由于含有重金属锇原子,对电子的阻挡性较佳,故广泛用作穿透式电子显微镜组织标本的染剂,能增强影像的对比度。[8]OsO4的强氧化性使其能与未饱和碳-碳键反应,从而连接脂质。因此在染色的同时,它还会固定生物膜,从而使样本结构特征不被破坏,也能快速杀死原生动物等会移动的活体样本。
锇矿石精炼[编辑]
OsO4是从矿石中提取锇的中间产物。将含锇残留物用过氧化钠(Na2O2)处理,形成可溶的Na2[OsO4(OH)2]。该盐与氯反应形成OsO4。在精炼的最后步骤,粗制的OsO4溶解在NaOH醇中形成Na2[OsO2(OH)4],用氯化铵(NH4Cl)处理后得到(NH4)4[OsO2Cl2]。将此盐在氢气中还原,即可得到锇。[9]
药物[编辑]
四氧化锇唯一已知的临床用途是治疗关节炎。[10]由于缺乏有关局部施用四氧化锇的长期副作用的报告,说明锇本身可能具有生物相容性,尽管这取决于所施用的锇化合物种类。2011年,有报告指出锇(VI)[11]和锇(II)[12]化合物在体内具抗癌活性,显示使用锇化合物作为抗癌药物具有广阔的前景。[13]
安全性[编辑]
四氧化锇的挥发性很高,能轻易穿透皮肤,且经吸入、进食和皮肤接触后都是毒物。[14]如果空气中含有低浓度四氧化锇,会造成肺淤血及皮肤和眼部损害,人眼接触四氧化锇后会对角膜进行不可逆的染色,从而导致失明。因此涉及四氧化锇的实验必须在通风柜内操作。[15]四氧化锇的容许暴露限值(8小时时间加权平均值)为2 µg/m3。[16]由于四氧化锇可以穿透塑胶和食品包装,因此必须在玻璃容器中冷藏保存。[17]
外部链接[编辑]
- 国际化学安全卡 0528(页面存档备份,存于互联网档案馆)
- NIOSH Pocket Guide to Chemical Hazards(页面存档备份,存于互联网档案馆)
- BBC report on bomb plot(页面存档备份,存于互联网档案馆)
- BBC 什么是四氧化锇(页面存档备份,存于互联网档案馆)
- 四氧化锇: 本月的化合物(页面存档备份,存于互联网档案馆)
- 化学反应(页面存档备份,存于互联网档案馆)
参考文献[编辑]
- ^ Girolami, Gregory. Osmium weighs. Nature Chemistry. 2012, 4 (11): 954. Bibcode:2012NatCh...4..954G. PMID 23089872. doi:10.1038/nchem.1479
 .
.
- ^ Cotton and Wilkinson, Advanced Inorganic Chemistry, p.1002
- ^ Dr. M Thomson, Osmium tetroxide (OsO4). [1] (页面存档备份,存于互联网档案馆)
- ^ 4.0 4.1 《无机化学丛书》.张青莲 主编.第九卷.P439. 3.2.2氧化物
- ^ 5.0 5.1 Housecroft & Sharpe. Inorganic Chemistry. (ed 2, 2005). p 671-673
- ^ Christe et al. "Osmium tetrafluoride dioxide, cis-OsO2F4". J. Am. Chem. Soc. 1993, 115. doi:11279-11284
- ^ Housecroft & Sharpe. Inorganic Chemistry. (ed 2, 2005). p 672,710
- ^ Bozzola, J. J.; Russell, L. D. Specimen Preparation for Transmission Electron Microscopy. Electron Microscopy: Principles and Techniques for Biologists. Sudbury, MA: Jones and Bartlett. 1999: 21–31. ISBN 978-0-7637-0192-5.
- ^ Thompson, M. Osmium tetroxide (OsO4). Bristol University. [2012-04-07]. (原始内容存档于2013-09-22).
- ^ Sheppeard, H.; D. J. Ward. Intra-articular osmic acid in rheumatoid arthritis: five years' experience. Rheumatology. 1980, 19 (1): 25–29. PMID 7361025. doi:10.1093/rheumatology/19.1.25.
- ^ Lau, T.-C; W.-X. Ni; W.-L. Man; M. T.-W. Cheung; et al. Osmium(vi) complexes as a new class of potential anti-cancer agents. Chem. Commun. 2011, 47 (7): 2140–2142. PMID 21203649. S2CID 1851467. doi:10.1039/C0CC04515B.
- ^ Sadler, Peter; Steve D. Shnyder; Ying Fu; Abraha Habtemariam; et al. Anti-colorectal cancer activity of an organometallic osmium arene azopyridine complex (PDF). Med. Chem. Commun. 2011, 2 (7): 666–668 [2023-11-06]. doi:10.1039/C1MD00075F. (原始内容存档 (PDF)于2023-07-15).
- ^ Fu, Ying; Romero, María J.; Habtemariam, Abraha; et al. The contrasting chemical reactivity of potent isoelectronic iminopyridine and azopyridine osmium(II) arene anticancer complexes (PDF). Chemical Science. 2012, 3 (8): 2485–2494 [2023-11-06]. doi:10.1039/C2SC20220D. (原始内容存档 (PDF)于2023-01-17).
- ^ Luttrell, William E.; Giles, Cory B. Toxic tips: Osmium tetroxide. Journal of Chemical Health and Safety. 2007, 14 (5): 40–41. doi:10.1016/j.jchas.2007.07.003.
- ^ Mager Stellman, J. Osmium. Encyclopaedia of Occupational Health and Safety. International Labour Organization. 1998: 63.34. ISBN 978-92-2-109816-4. OCLC 35279504.
- ^ Osmium tetroxide (as Os). Documentation for Immediately Dangerous to Life or Health Concentrations (IDLHs). Centers for Disease Control. 2 November 2018 [2023-11-06]. (原始内容存档于2023-05-30).
- ^ Hayat, M. A. Principles and Techniques of Electron Microscopy: Biological Applications. Cambridge University Press. 2000: 45–61. ISBN 0-521-63287-0.
- Cotton, S. A. "Chemistry of Precious Metals," Chapman and Hall (London): 1997. ISBN 0-7514-0413-6.
- Berrisford, D. J.; Bolm, C.; Sharpless, K. B., "Ligand Accelerated Catalysis", Angewandte Chemie, International Edition English, 1995, volume 34, pp. 1059-1070.
| |||||||