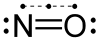一氧化氮
| 此條目缺少或沒有列出參考或來源,或者有未能查證的內容。 (2011年10月2日) |
| 一氧化氮 | |||
|---|---|---|---|

| |||
| |||
| IUPAC名 Nitric oxide[1] | |||
| 系統名 Oxidonitrogen(•)[2] (additive) | |||
| 別名 | 氧化氮(II) | ||
| 識別 | |||
| CAS編號 | 10102-43-9 | ||
| PubChem | 145068 | ||
| ChemSpider | 127983 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | MWUXSHHQAYIFBG-UHFFFAOYAI | ||
| Gmelin | 451 | ||
| 3DMet | B00122 | ||
| UN編號 | 1660 | ||
| EINECS | 233-271-0 | ||
| ChEBI | 16480 | ||
| RTECS | QX0525000 | ||
| DrugBank | DB00435 | ||
| KEGG | D00074 | ||
| IUPHAR配位基 | 2509 | ||
| 性質 | |||
| 化學式 | NO | ||
| 莫耳質量 | 30.01 g·mol−1 | ||
| 外觀 | 無色氣體 | ||
| 密度 | 1.3402 g/L | ||
| 熔點 | −164 °C(109 K) | ||
| 沸點 | −152 °C(121 K) | ||
| 溶解性(水) | 0.0098 g / 100 ml (0 °C) 0.0056 g / 100 ml (20 °C) | ||
| 折光度n D |
1.0002697 | ||
| 結構 | |||
| 分子構型 | 線形 | ||
| 熱力學 | |||
| ΔfHm⦵298K | 91.29 kJ/mol | ||
| S⦵298K | 210.76 J/(K·mol) | ||
| 藥理學 | |||
| ATC代碼 | R07AX01(R07) | ||
| 藥品許可證 | |||
| 給藥途徑 | 吸入 | ||
| 藥代動力學: | |||
| 好 | |||
| 肺毛細血管床 | |||
| 2至6秒 | |||
| 危險性 | |||
GHS危險性符號    [3][4] [3][4]
| |||
| GHS提示詞 | Danger | ||
| H-術語 | H270, H280, H330, H314[3][4] | ||
| P-術語 | P244, P260, P220, P280, P304+340, P303+361+353, P305+351+338, P370+376, P403, P405[3][4] | ||
| 主要危害 | 吸入致命、造成嚴重燒傷、造成眼睛損傷、對呼吸道有腐蝕性[4] | ||
| NFPA 704 | |||
| 致死量或濃度: | |||
LC50(中位濃度)
|
315 ppm(兔子,15 min) 854 ppm (大鼠, 4 h) 2500 ppm(小鼠,12 min)[5] | ||
LCLo(最低)
|
320 ppm (小鼠)[5] | ||
| 相關物質 | |||
| 相關氮氧化物 | 五氧化二氮 四氧化二氮 三氧化二氮 二氧化氮 一氧化二氮 次硝酸 羥胺 | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
一氧化氮是氮的化合物,化學式NO,分子量30,氮化合價+2,是無色、無味、難溶於水的有毒氣體。一氧化氮是自由基,化學性質非常活潑。有順磁性。與氧反應可形成腐蝕氣體二氧化氮(NO₂)。標準狀況下為無色氣體,液態、固態呈藍色。
作用[編輯]
一氧化氮起信號分子作用。[6]它是脊椎動物的關鍵訊息傳遞分子,在各種生物過程中發揮作用。[7]它是幾乎所有生物的生物產品,包括細菌、植物、真菌和動物細胞。[8]
當內皮要向肌肉發出放鬆指令以促進血液流通時,它就會產生一些一氧化氮分子,這些分子很小,能很易穿過細胞膜。血管周圍的平滑肌細胞接收信號後舒張,使血管擴張並增加血流量。[9]西地那非是使用一氧化氮途徑的藥物。它並不產生一氧化氮,但它通過保護環磷酸鳥苷免受海綿體內cGMP特異性磷酸二酯酶5型降解來增強一氧化氮通路下游的信號,舒張血管。[10]另一種信號分子,硫化氫與一氧化氮一起以協同方式誘導血管舒張和血管生成。[11][12]
機體飢餓狀態下,一氧化氮對肝臟中脂肪代謝起著關鍵調控作用,其合成受阻會導致肝臟脂肪病變[13]。
一氧化氮也能在神經系統的細胞中發揮作用。它對周圍神經末梢或許有所作用。
免疫系統產生的一氧化氮分子,不僅能抗擊侵入人體的微生物,而且還能在一定程度阻止癌細胞繁殖,阻止腫瘤細胞擴散。
結構[編輯]
一氧化氮為雙原子分子,分子構型為直線型。一氧化氮中,氮與氧之間形成一條σ鍵、一條雙電子π鍵與一條3電子π鍵。氮氧間鍵級為2.5,氮與氧各有一對孤對電子。有11粒價電子,是奇電子分子,順磁。分子軌域式:
- (σ1s)2(σ1s*)2(σ2s)2(σ2s*)2(σ2p)2(π2p)4(π2p*)1
反鍵軌域上(π2p*)1易失去生成亞硝醯陽離子NO+:
- 2 NO+Cl₂ → 2 NOCl
可二聚生成(NO)₂,固體有少量之:
- 2 NO → (NO)₂
(NO)₂的結構為氧=氮-氮=氧,分子為平面型,屬C2v點群[14]。
性質[編輯]
還原[編輯]
一氧化氮易氧化生成二氧化氮,一氧化氮在空氣中很快會由氧氧化成紅棕色二氧化氮。工業用此法生產硝酸。
- 2 NO+O₂ → 2 NO₂
配位[編輯]
孤對電子使一氧化氮易與金屬離子形成錯合物。可與血紅蛋白結合,使人窒息中毒。
如一氧化氮可與Fe²⁺/Fe(II)生成棕色亞硝醯亞鐵離子,稱為棕環反應,為檢驗亞鐵離子的一種反應:
- Fe²⁺+NO+5H₂O → [Fe(H₂O)₅NO]²⁺
生物活性[編輯]
- 心血管中,一氧化氮對維持血管張力的恆定與調節血壓穩定起重要作用。硝化甘油治療心絞痛正是由於其在體內轉化成NO,擴張血管。
- 免疫系統中,NO起殺傷細菌、病毒、腫瘤細胞的作用。
- 神經系統中,一氧化氮促進學習、記憶過程,並可調節腦血流。
- 肝臟代謝中,一氧化氮對飢餓狀態下肝臟中自由脂肪酸氧化起著關鍵調控作用。
生產與製備[編輯]
工業以奧斯特瓦爾德法生產一氧化氮,鉑催化氨在750至900°C(通常為850°C)氧化生成:
- 4 NH₃+5 O₂ ⇌ 4 NO+6 H₂O
氧和氮的未催化吸熱反應在自然界由高溫(>2000°C)與閃電實現,並沒有發展為一種實際的工業合成方法(伯克蘭-艾德法):
- N₂+O₂ → 2 NO
實驗室[編輯]
- 3 Cu+8 HNO₃ → 3 Cu(NO₃)₂+2 NO↑+4H₂O
另一種途徑是以亞硝酸鹽形式還原亞硝酸:
- 2 NaNO₂+2 NaI+2 H₂SO₄ → I₂+2 Na₂SO₄+2 H₂O+2 NO↑
- 2 NaNO₂+2 FeSO₄+3 H₂SO₄ → Fe₂(SO₄)₃+2 NaHSO₄+2 H₂O+2 NO↑
- 3 KNO₂+KNO₃+Cr₂O₃ → 2 K₂CrO₄+4 NO↑
硫酸亞鐵路線簡單,有用於本科實驗室。NONOate化合物也可用於製取一氧化氮。
參考資料[編輯]
- ^ 存档副本. [2021-07-10]. (原始內容存檔於2021-07-28).
- ^ Nitric Oxide (CHEBI:16480). Chemical Entities of Biological Interest (ChEBI). UK: European Bioinformatics Institute. [2021-07-10]. (原始內容存檔於2011-05-11).
- ^ 3.0 3.1 3.2 Nitrogen monoxide - Registration Dossier - ECHA. [2020-11-02].
- ^ 4.0 4.1 4.2 4.3 Safety Data Sheet - Nitric Oxide, compressed - Registration Dossier (PDF). [2020-11-02]. (原始內容 (PDF)存檔於2021-06-28).
- ^ 5.0 5.1 Nitric oxide. Immediately Dangerous to Life and Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ Liu, Hongying; Weng, Lingyan; Yang, Chi. A review on nanomaterial-based electrochemical sensors for H2O2, H2S and NO inside cells or released by cells. Microchimica Acta. 2017-03-28, 184 (5): 1267–1283. ISSN 0026-3672. S2CID 21308802. doi:10.1007/s00604-017-2179-2.
- ^ Weller, Richard, Could the sun be good for your heart? (頁面存檔備份,存於網際網路檔案館) TedxGlasgow. Filmed March 2012, posted January 2013
- ^ Roszer, T (2012) The Biology of Subcellular Nitric Oxide. ISBN 978-94-007-2818-9
- ^ Stryer, Lubert. Biochemistry, 4th Edition. W.H. Freeman and Company. 1995: 732. ISBN 978-0-7167-2009-6.
- ^ Perez, Krystle M.; Laughon, Matthew. Sildenafil in Term and Premature Infants: A Systematic Review. Clinical Therapeutics. November 2015, 37 (11): 2598–2607.e1. ISSN 0149-2918. PMID 26490498. doi:10.1016/j.clinthera.2015.07.019.
- ^ Szabo, Csaba; Coletta, Ciro; Chao, Celia; Módis, Katalin; Szczesny, Bartosz; Papapetropoulos, Andreas; Hellmich, Mark R. Tumor-derived hydrogen sulfide, produced by cystathionine-β-synthase, stimulates bioenergetics, cell proliferation, and angiogenesis in colon cancer. Proceedings of the National Academy of Sciences of the United States of America. 2013-07-23, 110 (30): 12474–12479. Bibcode:2013PNAS..11012474S. ISSN 1091-6490. PMC 3725060
 . PMID 23836652. doi:10.1073/pnas.1306241110.
. PMID 23836652. doi:10.1073/pnas.1306241110.
- ^ Altaany, Zaid; Yang, Guangdong; Wang, Rui. Crosstalk between hydrogen sulfide and nitric oxide in endothelial cells. Journal of Cellular and Molecular Medicine. July 2013, 17 (7): 879–888. ISSN 1582-4934. PMC 3822893
 . PMID 23742697. doi:10.1111/jcmm.12077.
. PMID 23742697. doi:10.1111/jcmm.12077.
- ^ Gu, Qilin; Yang, Xiaojie; Lin, Li; Li, Shaoyang; Li, Qing; Zhong, Shan; Peng, Jinrong; Cui, Zongbin. Genetic ablation of solute carrier family 7a3a leads to hepatic steatosis in zebrafish during fasting. Hepatology. 2014-12, 60 (6): 1929–1941. ISSN 0270-9139. doi:10.1002/hep.27356 (英語).
- ^ 麥松威,周公度,李偉基。高等無機結構化學。pp. 471-472
| |||||||||||||||||||||||||||||||||||||
|