氰化鈣
| 氰化鈣 | |
|---|---|
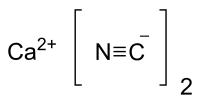
| |
| IUPAC名 Calcium cyanide | |
| 識別 | |
| CAS號 | 156-62-7 |
| PubChem | 4685067 |
| ChemSpider | 10669887 |
| SMILES |
|
| InChI |
|
| InChIKey | STRTXDFFNXSZQB-UHFFFAOYAA |
| UN編號 | 1403 |
| EINECS | 205-861-8 |
| RTECS | GS6000000 |
| 性質 | |
| 化學式 | CaCN2 |
| 莫耳質量 | 80.102 g/mol g·mol⁻¹ |
| 外觀 | 白色固體(不純時呈灰黑色) |
| 氣味 | 無味 |
| 密度 | 2.29 g/cm3 |
| 熔點 | 1340 °C [1] |
| 沸點 | 1150-1200 °C (昇華) |
| 溶解性(水) | 反應 |
| 危險性 | |
| 警示術語 | R:R22 R37 R41 |
| 安全術語 | S:S2 S22 S26 S36/37/39 |
| MSDS | ICSC 1639 |
| 歐盟編號 | 615-017-00-4 |
| 歐盟分類 | 有害 (Xn) 刺激性 (Xi) |
| NFPA 704 | |
| 閃點 | 非易燃 |
| 相關物質 | |
| 相關化學品 | 氰化鈉 氰氨化鈣 電石 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
氰化鈣(化學式:Ca(CN)2),無色或白色粉末,工業品呈灰黑色,味苦,有劇毒。
性質[編輯]
溶於水和弱酸,生成氰化氫(HCN);暴露於潮濕空氣中也會放出劇毒氣體。
和硫反應產生硫氰酸鈣:
- Ca(CN)2 + S → Ca(SCN)2
製備[編輯]
可用氰氨化鈣與碳共熱至1000℃以上而得。
安全[編輯]
攝入後會和其他的氰化物一樣,當這化合物被吸收進血液時,當中的氰離子即時進入所有細胞中,而且抑制在細胞中的粒線體中的細胞色素氧化酶(a3),引致在呼吸作用中,電子傳遞鏈不能順利進行,從而使細胞無法藉需氧呼吸獲得能量,引致細胞只能進行缺氧呼吸以維持生命活動,造成細胞窒息。
此外,由於所有細胞都只能進行缺氧呼吸,肝臟細胞又無法進行需氧呼吸以把缺氧呼吸得出的乳酸氧化或轉變成糖原,引致乳醱積累在血液中,造成血液的pH值下降,引致代謝性醱中毒。血液中pH值的進一步下降更加把身體細胞中大部份的酶進一步抑制,使身體機能癱瘓,引致死亡。
吸入、口服或經皮吸收可引起急性中毒,大劑量吸入會死亡。
參考資料[編輯]
- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0070494398
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

