二氧化碳性質表
基本訊息[編輯]
- 中文名:二氧化碳、乾冰(固態)
- 化學式:CO2
- CAS號:124-38-9(CO2)、1111-72-4(13CO2)、51-90-1(14CO2)、18983-82-9(C(18O)O)、2537-69-1(C(18O)2)
- 英文名:Carbon dioxide
- 外觀:無色氣體(標況);氣態、液態、水溶液和超臨界態均為無色;固態時為無色或白色固體
結構與性質[編輯]
| 結構與性質 | |
|---|---|
| 折射率, nD | 1.000449 at 589.3 nm and 0 °C [1] |
| 介電常數, εr | 1.60 ε0(0 °C, 50 atm) |
| C=O鍵平均鍵能 | 804.4 kJ/mol at 298 K(25 °C)[2] |
| 鍵長 | C=O 116 pm (1.16 Å) [來源請求] |
| 鍵角 | O-C-O: 180° |
| 磁化率 | ? |
| 表面張力 | 4.34 dyn/cm(20 °C,平衡壓力) |
| 平衡壓力下的液體黏度[3] | 0.0925 mPa·s at 5 °C 0.0852 mPa·s at 10 °C 0.0712 mPa·s at 20 °C 0.0625 mPa·s at 25 °C 0.0321 mPa·s at 31.1 °C |
熱力學性質[編輯]
| 相性質 | |
|---|---|
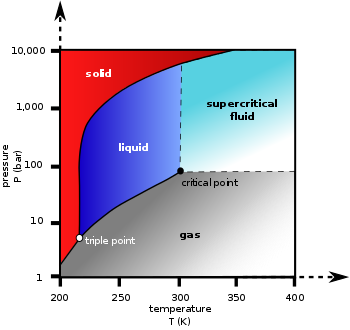
| 三相點 | 216.58 K(−56.57 °C), 518.5 kPa |
| 臨界點 | 304.18 K(31.03 °C), 7.38 MPa |
| 標準熔化焓變, ΔfusH |
8.647 kJ/mol(三相點)[4] |
| 標準熔化熵變, ΔfusS |
? J/(mol·K) |
| 標準汽化焓變,[5] ΔvapH |
15.326 kJ/mol at 215.7 K(−57.5 °C) |
| 標準汽化熵變, ΔvapS |
70.8 J/(mol·K) |
| 固體性質 | |
| 標準摩爾生成焓, ΔfH |
-427.4 kJ/mol |
| 標準摩爾熵,[6] S |
51.07 J/(mol·K) |
| 熱容量,[6] cp | 2.534 J/(mol·K) at 15.52 K(−257.63 °C) 47.11 J/(mol·K) at 146.48 K(−126.67 °C) 54.55 J/(mol·K) at 189.78 K(−83.37 °C) |
| 液體性質 | |
| 標準摩爾生成焓, ΔfH |
? kJ/mol |
| 標準摩爾熵, S |
? J/(mol K) |
| 熱容量, cp | ? J/(mol·K) |
| 導熱係數[7] | 31.0×10-5 cal/cm·s·°C(-20°C) 25.4×10-5 cal/cm·s·°C(0°C) 19.7×10-5 cal/cm·s·°C(20°C) |
| 蒸汽壓[7] | 19.449 atm(-20°C) 34.397 atm(0°C) 56.525 atm(20°C)71.166(30°C) |
| 溶液性質 | |
| 亨利常數[8] | 條件:298 K [bmim][PF6] 53.4±0.3, [bmim][BF4] 59.0±2.6, [bmim][Tf2N] 33.0±0.3, [hmim][Tf2N] 31.6±0.2, 條件:333 K [hmim][eFAP] 42.0±0.1, [Et3NBH2mim][Tf2N] 113.1±16.9 |
| 氣體性質 | |
| 標準摩爾生成焓, ΔfH |
−393.52 kJ/mol |
| 標準摩爾熵, S |
213.79 J/(mol·K) |
| 熱容量,[9] cp | 33.89 J/(mol K) at –75 °C 36.33 J/(mol K) at 0 °C 36.61 J/(mol K) at 15 °C 38.01 J/(mol K) at 100 °C 43.81 J/(mol K) at 400 °C 50.87 J/(mol K) at 1000 °C 56.91 J/(mol K) at 2000 °C 53.01 J/(mol K) at 38 °C, 2457 kPa 60.01 J/(mol K) at 38 °C, 5482 kPa 183.1 J/(mol K) at 38 °C, 8653 kPa |
| 絕熱指數[9] γ = cp/cv |
1.37 at –75 °C 1.310 at 0 °C 1.304 at 15 °C 1.281 at 100 °C 1.235 at 400 °C 1.195 at 1000 °C 1.171 at 2000 °C |
| 范德華常數[10] | a = 363.96 L2 kPa/mol2 b = 0.04267 liter per mole |
| 與一氧化碳的化學平衡[11] CO + ½O 2 → CO 2 K = pK = log10 K |
pK = 45.0438 at T = 298.16 K pK = 25.0054 at T = 500 K pK = 16.5383 at T = 700 K pK = 11.8409 at T = 900 K pK = 8.8583 at T = 1100 K pK = 6.7989 at T = 1300 K pK = 5.2943 at T = 1500 K |
溶解度[編輯]
| CO2在101.3 kPa (1 atm)分壓下水中的溶解度[12] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
- ‡Second column of table indicates solubility at each given temperature in volume of CO2 as it would be measured at 101.3 kPa and 0 °C per volume of water.
- The solubility is given for "pure water", i.e., water which contain only CO2. This water is going to be acidic. For example, at 25 °C the pH of 3.9 is expected (see carbonic acid). At less acidic pH values, the solubility will increase because of the pH-dependent speciation of CO2.
固態和氣態時的蒸汽壓[編輯]
| P(mm Hg) | 1 | 10 | 40 | 100 | 400 | 760 | 1520 | 3800 | 7600 | 15200 | 30400 | 45600 | |
| P(atm) (2sf,換算自mm Hg) | 0.0013 | 0.013 | 0.053 | 0.13 | 0.53 | 1.0 | 2.0 | 5.0 | 10 | 20 | 40 | 60 | |
| P(kPa)(換算自mm Hg / atm) | 0.13 | 1.3 | 5.3 | 13 | 53 | 101.325 | 202.65 | 506.625 | 1013.25 | 2026.5 | 4053 | 6079.5 | |
| T(°C) | –134.3(s) | –119.5(s) | –108.6(s) | –100.2(s) | –85.7(s) | –78.2(s) | –69.1(s) | –56.7 | –39.5 | –18.9 | 5.9 | 22.4 | |
表格數據來自《CRC Handbook of Chemistry and Physics》第44版。注釋中的「(s)」表示固體上方蒸氣的平衡溫度。其餘溫度均為液體上方蒸汽的平衡溫度。對於kPa數值,給出了精確值,其他地方的2個有效數字計算自mmHg數值。

相圖[編輯]
液相/氣相平衡熱力學數據[編輯]
下表列出了液相CO2在不同溫度下與氣相平衡的熱力學數據。焓、汽化熱和熵是相對於0 °C、3483 kPa的數值。熱量值至J/mol需要乘以44.095 g/mol。將密度換算為mol/L需要乘以22.678 cm3-mol/L-g。數據來自《CRC Handbook of Chemistry and Physics》(第44版),pp. 2560-2561。臨界溫度曲線(31.1 °C)與溫度–30 °C來自《Lange's Handbook of Chemistry》(第10版),pp. 1463。
| 二氧化碳液-氣平衡熱力學數據 | ||||||||
| 溫度 °C |
Pvap 蒸汽壓 kPa |
Hliq 液體 焓 J/g |
Hvap 蒸氣 焓 J/g |
ΔvapH 汽化 熱 J/g |
ρvap 蒸氣 密度 g/cm3 |
ρliq 液體 密度 g/cm3 |
Sliq 液體 熵 J/mol-°C |
Svap 蒸氣 熵 J/mol-°C |
|---|---|---|---|---|---|---|---|---|
| –56.6 | 518.3 | 1.179 | ||||||
| –56.0 | 531.8 | 1.177 | ||||||
| –54.0 | 579.1 | 1.169 | ||||||
| –52.0 | 629.6 | 1.162 | ||||||
| –50.0 | 683.4 | 1.155 | ||||||
| –48.0 | 740.6 | 1.147 | ||||||
| –46.0 | 801.3 | 1.139 | ||||||
| –44.0 | 865.6 | 1.131 | ||||||
| –42.0 | 933.8 | 1.124 | ||||||
| –40.0 | 1005.7 | 1.116 | ||||||
| –38.0 | 1081.9 | 1.108 | ||||||
| –36.0 | 1161.8 | 1.100 | ||||||
| –34.0 | 1246.2 | 1.092 | ||||||
| –32.0 | 1335.1 | 1.084 | ||||||
| -30.0 | 1428.6 | 1.075 | ||||||
| –28.89 | 1521 | –55.69 | 237.1 | 292.9 | 0.03846 | 1.0306 | –9.48 | 43.41 |
| –27.78 | 1575 | –53.76 | 237.3 | 291.0 | 0.03987 | 1.0276 | –9.13 | 43.21 |
| –26.67 | 1630 | –51.84 | 237.6 | 289.4 | 0.04133 | 1.0242 | –8.78 | 43.01 |
| –25.56 | 1686 | –49.87 | 237.6 | 287.5 | 0.04283 | 1.0209 | –8.45 | 42.78 |
| –24.44 | 1744 | –47.91 | 237.8 | 285.7 | 0.04440 | 1.0170 | –8.10 | 42.56 |
| –23.33 | 1804 | –45.94 | 237.8 | 283.6 | 0.04600 | 1.0132 | –7.75 | 42.36 |
| –22.22 | 1866 | –43.93 | 237.8 | 281.7 | 0.04767 | 1.0093 | –7.40 | 42.14 |
| –21.11 | 1928 | –41.92 | 237.8 | 279.6 | 0.04938 | 1.0053 | –7.05 | 41.94 |
| –20.00 | 1993 | –39.91 | 237.8 | 277.8 | 0.05116 | 1.0011 | –6.68 | 41.71 |
| –18.89 | 2059 | –37.86 | 237.8 | 275.7 | 0.05300 | 0.9968 | –6.31 | 41.49 |
| –17.78 | 2114 | –35.82 | 237.6 | 273.6 | 0.05489 | 0.9923 | –5.98 | 41.27 |
| –16.67 | 2197 | –33.73 | 237.6 | 271.2 | 0.05686 | 0.9875 | –5.61 | 41.05 |
| –15.56 | 2269 | –31.64 | 237.3 | 269.2 | 0.05888 | 0.9829 | –5.26 | 40.83 |
| –14.44 | 2343 | –29.54 | 237.3 | 266.9 | 0.06098 | 0.9782 | –4.91 | 40.61 |
| –13.33 | 2418 | –27.41 | 237.1 | 264.5 | 0.06314 | 0.9734 | –4.54 | 40.39 |
| –12.22 | 2495 | –25.27 | 236.9 | 262.2 | 0.06539 | 0.9665 | –4.17 | 40.15 |
| –11.11 | 2574 | –23.09 | 236.7 | 259.7 | 0.06771 | 0.9639 | –3.80 | 39.92 |
| –10.00 | 2654 | –20.90 | 236.4 | 257.3 | 0.07011 | 0.9592 | –3.43 | 39.68 |
| –8.89 | 2738 | –18.69 | 235.9 | 254.8 | 0.07259 | 0.9543 | –3.06 | 39.46 |
| –7.78 | 2823 | –16.45 | 235.7 | 252.2 | 0.07516 | 0.9494 | –2.69 | 39.22 |
| –6.67 | 2910 | –14.18 | 235.2 | 249.4 | 0.07783 | 0.9443 | –2.32 | 38.98 |
| –5.56 | 2999 | –11.90 | 234.8 | 246.6 | 0.08059 | 0.9393 | –1.94 | 38.74 |
| –4.44 | 3090 | –9.977 | 234.3 | 243.8 | 0.08347 | 0.9340 | –1.57 | 38.50 |
| –3.89 | 3136 | –8.410 | 234.1 | 242.4 | 0.08494 | 0.9313 | –1.37 | 38.37 |
| –2.78 | 3230 | –6.046 | 233.6 | 239.7 | 0.08797 | 0.9260 | –0.98 | 38.12 |
| –1.67 | 3327 | –3.648 | 232.9 | 236.6 | 0.09111 | 0.9206 | –0.59 | 37.88 |
| –0.56 | 3425 | –1.222 | 232.4 | 233.6 | 0.09438 | 0.9150 | –0.20 | 37.62 |
| 0.56 | 3526 | 1.234 | 231.7 | 230.5 | 0.09776 | 0.9094 | 0.20 | 37.36 |
| 1.67 | 3629 | 3.728 | 231.0 | 227.3 | 0.1013 | 0.9036 | 0.61 | 37.08 |
| 2.78 | 3735 | 6.268 | 230.4 | 224.0 | 0.1050 | 0.8975 | 1.01 | 36.83 |
| 3.89 | 3843 | 8.445 | 229.4 | 220.5 | 0.1088 | 0.8914 | 1.42 | 36.55 |
| 5.00 | 3953 | 11.46 | 228.5 | 217.0 | 0.1128 | 0.8850 | 1.83 | 36.25 |
| 6.11 | 4067 | 14.13 | 227.6 | 213.4 | 0.1169 | 0.8784 | 2.25 | 35.98 |
| 7.22 | 4182 | 16.85 | 226.5 | 209.7 | 0.1213 | 0.8716 | 2.69 | 35.68 |
| 8.33 | 4300 | 19.63 | 225.4 | 205.8 | 0.1258 | 0.8645 | 3.12 | 35.39 |
| 9.44 | 4420 | 22.46 | 224.3 | 201.8 | 0.1306 | 0.8571 | 3.56 | 35.07 |
| 10.56 | 4544 | 25.36 | 223.1 | 197.7 | 0.1355 | 0.8496 | 4.02 | 34.76 |
| 11.67 | 4670 | 28.33 | 221.8 | 193.4 | 0.1408 | 0.8418 | 4.48 | 34.45 |
| 12.78 | 4798 | 31.35 | 220.3 | 188.9 | 0.1463 | 0.8338 | 4.94 | 34.11 |
| 13.89 | 4929 | 34.49 | 218.8 | 184.3 | 0.1521 | 0.8254 | 5.42 | 33.76 |
| 15.00 | 5063 | 37.30 | 217.2 | 179.5 | 0.1583 | 0.8168 | 5.92 | 33.41 |
| 16.11 | 5200 | 41.03 | 215.1 | 174.4 | 0.1648 | 0.8076 | 6.42 | 33.02 |
| 17.22 | 5340 | 44.48 | 213.6 | 169.1 | 0.1717 | 0.7977 | 6.96 | 32.66 |
| 18.33 | 5482 | 48.03 | 211.5 | 163.5 | 0.1791 | 0.7871 | 7.49 | 32.25 |
| 19.44 | 5628 | 51.71 | 209.4 | 157.6 | 0.1869 | 0.7759 | 8.04 | 31.83 |
| 20.56 | 5776 | 55.61 | 207.0 | 151.4 | 0.1956 | 0.7639 | 8.63 | 31.38 |
| 21.67 | 5928 | 59.66 | 204.3 | 144.7 | 0.2054 | 0.7508 | 9.24 | 30.90 |
| 22.78 | 6083 | 63.97 | 201.5 | 137.5 | 0.2151 | 0.7367 | 9.89 | 30.39 |
| 23.89 | 6240 | 68.58 | 198.4 | 129.8 | 0.2263 | 0.7216 | 10.57 | 29.85 |
| 25.00 | 6401 | 73.51 | 194.8 | 121.3 | 0.2387 | 0.7058 | 11.31 | 29.24 |
| 26.11 | 6565 | 78.91 | 190.7 | 111.8 | 0.2532 | 0.6894 | 12.10 | 28.60 |
| 27.22 | 6733 | 84.94 | 186.0 | 101.1 | 0.2707 | 0.6720 | 12.99 | 27.84 |
| 28.33 | 6902 | 91.88 | 180.4 | 88.49 | 0.2923 | 0.6507 | 14.00 | 26.95 |
| 29.44 | 7081 | 100.4 | 173.1 | 72.72 | 0.3204 | 0.6209 | 15.24 | 25.85 |
| 30.00 | 7164 | 105.6 | 168.4 | 62.76 | 0.3378 | 0.5992 | 16.01 | 25.15 |
| 30.56 | 7253 | 112.3 | 162.3 | 50.04 | 0.3581 | 0.5661 | 16.99 | 24.24 |
| 31.1 | 7391 | 0.00 | 0.4641 | 0.4641 | ||||
| 溫度 °C |
Pvap 蒸汽壓 kPa |
Hliq 液體 焓 J/g |
Hvap 蒸氣 焓 J/g |
ΔvapH 汽化 熱 J/g |
ρvap 蒸氣 密度 g/cm3 |
ρliq 液體 密度 g/cm3 |
Sliq 液體 熵 J/mol-°C |
Svap 蒸氣 熵 J/mol-°C |
譜圖數據[編輯]
| UV-Vis | |
|---|---|
| λmax | ? nm |
| 消光係數, ε | ? |
| IR[a] | |
| 主要吸收峰[來源請求] | 2350 and 667 cm−1
(4.25 and 14.99 um) |
| NMR | |
| 1H NMR | 不適用 |
| 13C NMR | 125.0[13] |
| MS | |
| 主要碎片質量 | |
化學反應方程式[編輯]
| 反應物 | 反應方程式 | 反應條件 |
|---|---|---|
| 水 | CO2 + H2O ⇌ H2CO3 | 常溫、常壓 |
| 氧化物 | CO2 + CaO = CaCO3 CO2 + BaO = BaCO3 |
|
| 氫氧化物 | CO2 + 2 NaOH = Na2CO3 + H2O CO2 + 2 KOH = K2CO3 + H2O |
固體或溶液 |
| 碳酸鹽 | CO2 + H2O + Na2CO3 → 2 NaHCO3 CO2 + H2O + K2CO3 → 2 KHCO3 CO2 + H2O + Cs2CO3 → 2 CsHCO3 CO2 + H2O + CaCO3 ⇌ Ca(HCO3)2 |
溶液 |
| 銅、氧氣 | 2 Cu + O2 + CO2 + H2O → Cu2(OH)2CO3(水合物) | 潮濕空氣 |
| 氨 | CO2 + 2 NH3 → NH2COONH4 | 乾燥反應 |
| CO2 + 2 NH3 + H2O → (NH4)2CO3[14] | 溶液 | |
| 碳 | CO2 + C ⇌ 2 CO | 高溫 |
| 鎂 | CO2 + 2 Mg → 2 MgO + C | 點燃 |
| 金屬有機化合物 | RMgX + CO2 → RCOOH | |
| 苯酚鈉 | PhONa + CO2 → Ph(OH)COONa | |
化學品安全技術說明書[編輯]
二氧化碳的安全技術說明書(MSDS)可以參見此頁面(頁面存檔備份,存於網際網路檔案館)。
注釋[編輯]
- ^ 由於氮氣和氧氣分子是對稱的,而二氧化碳和水蒸氣不是,因此紅外分光光度計中的空氣可能會有二氧化碳和水的吸收。這很容易通過從實驗測得的光譜減去空白去除,而且儀器也可以用乾燥的氮氣吹掃。
參考文獻[編輯]
- ^ Refractive index of gases. NPL. [7 April 2010]. (原始內容存檔於2010-10-07). (頁面存檔備份,存於網際網路檔案館)
- ^ Darwent, B. deB. (1970). "Bond Dissociation Energies in Simple Molecules" Nat. Stand. Ref. Data Ser., Nat. Bur. Stand. (U.S.) 31, 52 pages.
- ^ Lange's Handbook of Chemistry, 10th ed. pp 1669-1674
- ^ Gas Encyclopaedia. Air Liquide. [1 June 2007]. (原始內容存檔於2016-11-23). (頁面存檔備份,存於網際網路檔案館)
- ^ 5.0 5.1 Pure Component Properties (Queriable database). Chemical Engineering Research Information Center. [8 May 2007]. (原始內容存檔於2007-06-03).
- ^ 6.0 6.1 W.F. Giauque and C.J. Egan, "Carbon Dioxide. The Heat Capacity and Vapor Pressure of the Solid. The Heat of Sublimation. Thermodynamic and Spectroscopic Values of the Entropy," Journal of Chemical Physics, vol. 5, pp. 45-54, 1937.
- ^ 7.0 7.1 盧煥章. 石油化工基礎數據手冊. 北京: 化工出版社
- ^ Jessica L. Anderson, JaNeille K. Dixon, Joan F. Brennecke. Solubility of CO 2 , CH 4 , C 2 H 6 , C 2 H 4 , O 2 , and N 2 in 1-Hexyl-3-methylpyridinium Bis(trifluoromethylsulfonyl)imide: Comparison to Other Ionic Liquids. Accounts of Chemical Research. 2007-11-20, 40 (11): 1208–1216 [2022-06-13]. ISSN 0001-4842. doi:10.1021/ar7001649. (原始內容存檔於2022-06-13) (英語). (頁面存檔備份,存於網際網路檔案館)
- ^ 9.0 9.1 Lange's Handbook of Chemistry, 10th ed, pp 1525-1528
- ^ Lange's Handbook of Chemistry, 10th ed, pp 1522-1524
- ^ Lange's Handbook of Chemistry, 10th ed. pp 1573-1576
- ^ Lange's Handbook of Chemistry, 10th ed., p 1100
- ^ Reich, H. J. C-13 Chemical Shifts. Organic Chem Info. University of Wisconsin. [31 May 2015]. (原始內容存檔於2015年3月2日). (頁面存檔備份,存於網際網路檔案館)
- ^ 碳酸銨 (頁面存檔備份,存於網際網路檔案館). Chemical Book. [2018-1-18]
不指明時,均指標準狀態。其餘信息參見Wikipedia:化學信息框。

![{\displaystyle \scriptstyle {\frac {[\mathrm {CO_{2}} ]}{[\mathrm {CO} ][\mathrm {O_{2}} ]^{\frac {1}{2}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/da2713312b3e86b12a4ad120a844803a4fbfbb24)