向山羥醛反應
| 反應物 |
|---|
 醛 (R1 = 芳基,烷基) 甲酸酯 (R1 = OR)[1] |
 烯醇硅醚 (R1 = 烷基,芳基,氫; R2 = 烷基,芳基,氫,OR,SR) |
向山羥醛反應(英語:Mukaiyama aldol reaction),是烯醇硅醚(及其類似物)在路易斯酸催化下與含羰基化合物(醛、酮或甲酸酯)間發生的一種羥醛反應,產物為β-羥基醛(酮),由向山光昭在1973年報道。[2][3][4]
此處烯醇硅醚為烯醇負離子的等效體,但其親核性不夠強,不能直接與酮反應,因此需加入路易斯酸以活化羰基。早期該反應使用化學劑量的路易斯酸,立體選擇性不佳。後來發現,如果仔細選擇底物和反應條件,可得較好的立體選擇性。近些年來此反應的進展集中於對手性催化劑的開發,及應用不對稱催化以高立體選擇性構建碳-碳鍵結構。
基本路線[編輯]
Mukaiyama反應是一種由路易斯酸介導的對含羰基化合物的羥醛反應,下圖是一個基本的反應示意(不含手性催化劑,R2 = H)[5]:

烯醇硅醚引發的羥醛反應能地得到四種產物的混合物,形成外消旋體。根據反應條件、底物結構和催化劑的不同,產物以非對映異構體為主,並有高度的不對稱誘導性[6]。

如由環己酮衍生的烯醇硅醚與苯甲醛發生的典型反應:
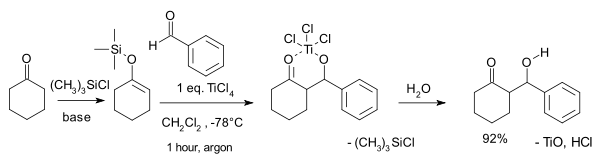
反應機理[編輯]
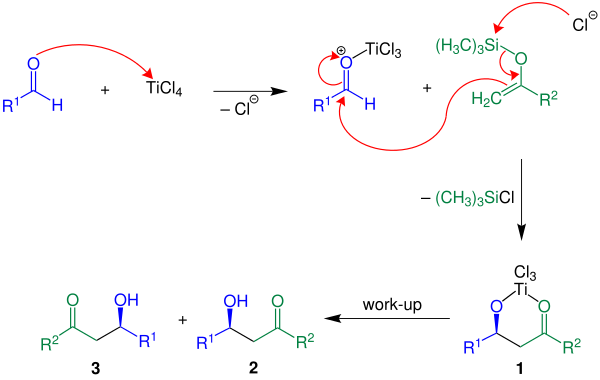
以TiCl4作路易斯酸為例,羰基先與路易斯酸接近配位,活化羰基,隨後烯醇硅醚親核進攻目標羰基,並立即形成碳-碳鍵。在水溶液處理後得到順式的外消旋體。
反應模型與羥醛反應的齊默曼-特拉克斯勒六元環過渡態模型不同,宜以開鏈過渡態模型解釋其立體選擇性。
例子[編輯]
- 酮之間的向山羥醛縮合反應需要更高的反應溫度,一個典型的例子是苯乙酮與丙酮間的反應:[7]

Mukaiyama Aldol between two ketones - Mukaiyama的紫杉醇全合成路線中引入了兩次羥醛反應[8][註 1]:
備註[編輯]
參見[編輯]
參考資料[編輯]
- ^ Mukaiyama, T.; Kobayashi, S. Tin(II) Enolates in the Aldol, Michael, and Related Reactions. Org. React. 1994, 46: 1. ISBN 0471264180. doi:10.1002/0471264180.or046.01.
- ^ New aldol type reaction Teruaki Mukaiyama, Koichi Narasaka and Kazuo Banno Chemistry Letters Vol.2 (1973) , No.9 pp.1011–1014 doi:10.1246/cl.1973.1011
- ^ REACTION OF ENOL ACETATE WITH ACETAL AND CARBONYL COMPOUND IN THE PRESENCE OF LEWIS ACID Teruaki Mukaiyama, Toshio Izawa and Kazuhiko Saigo Chemistry Letters Vol.3 (1974) , No.4 pp.323-326 doi:10.1246/cl.1974.323
- ^ Reactions of silyl enol ethers with carbonyl compounds activated by titanium tetrachloride Teruaki Mukaiyama, Kazuo Banno, and Koichi Narasaka J. Am. Chem. Soc.; 1974; 96(24) pp 7503–7509; doi:10.1021/ja00831a019
- ^ Kürti, László; Czakó, Barbara. Strategic applications of named reactions in organic synthesis : background and detailed mechanisms
 . Elsevier Academic Press. 2005: 298–299. ISBN 978-0-12-429785-2.
. Elsevier Academic Press. 2005: 298–299. ISBN 978-0-12-429785-2.
- ^ Smith, Michael B. March's Advanced Organic Chemistry 7th. Hoboken: John Wiley & Sons, Inc. 2013: 690. ISBN 978-0-470-46259-1.
- ^ Organic Syntheses, Coll. Vol. 8, p.323 (1993); Vol. 65, p.6 (1987). http://www.orgsynth.org/orgsyn/pdfs/CV8P0323.pdf (頁面存檔備份,存於網際網路檔案館)
- ^ Asymmetric Total Synthesis of Taxol Teruaki Mukaiyama , Isamu Shiina, Hayato Iwadare, Masahiro Saitoh, Toshihiro Nishimura, Naoto Ohkawa, Hiroki Sakoh, Koji Nishimura, Yu-ichirou Tani, Masatoshi Hasegawa, Koji Yamada , Katsuyuki Saitoh Chem. Eur. J. 1999, 5, No. 1 doi:10.1002/(SICI)1521-3765(19990104)5:1<121::AID-CHEM121>3.0.CO;2-O



