皮特森烯烴合成反應
皮特森烯烴合成(Peterson反應)是α-硅基碳負離子(如格氏試劑)與醛酮加成生成β-羥基有機硅烷,而後發生消除生成烯烴的反應。[1] 反應綜述:[2][3][4][5]。

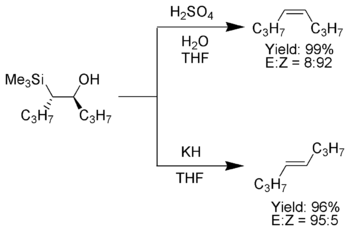
立體專一性是此反應的一個顯著特徵。同一條件下,用β-羥基硅烷的兩個非對映體分別發生消除,可以分別得到順式和反式的烯烴。此外,同一個β-羥基硅烷在酸和鹼介質中分別發生消除,也分別生成構型相反的烯烴。利用此性質可以控制產物烯烴的構型。
反應中不發生重排,具有很強的區域選擇性,可用於合成末端烯烴或環外烯烴。但酸性和鹼性的條件會使一些官能團受到破壞,比如雙鍵在酸作介質時會發生重排,使產率降低,從而限制了該反應的應用。對此有很多改進辦法。Chan等人的方法是用乙酰氯或氯化亞碸與羥基硅烷中間體反應,生成β-硅基酯,再使其在25°C發生分解,製取烯烴;[6] Corey等人是用α-硅基亞胺與醛酮反應,使中間體亞胺離子原位水解,一步製得烯烴。[7][8] Corey的方法也稱為Corey-Peterson反應。
反應機理[編輯]
鹼性介質[編輯]
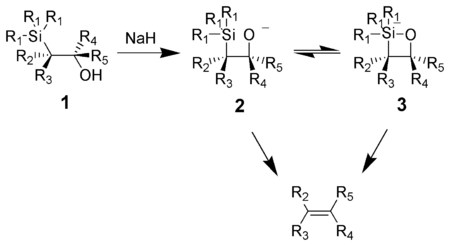
羥基硅烷在鹼作用下生成烷氧基負離子,進攻硅原子,形成四元環的中間體(推測),然後發生順式消除生成烯烴。
醇鹽作鹼時,醇鉀的反應速率最快,醇鈉其次,醇鎂最慢。這是因為氧原子的電子密度依次降低,親核性逐漸減弱的緣故。
酸性介質[編輯]
酸作用下,羥基質子化,然後水作親核試劑,進攻硅原子,發生E2消除生成烯烴。過渡態中硅基與質子化的羥基呈反疊構象。

雙鍵構型[編輯]
α-硅基碳負離子只含氫、烷基和供電子基時,中間體β-羥基硅烷比較穩定,可以在低溫下分離出來。對羥基硅烷的兩個非對映體進行拆分,然後用其中一個在酸作用下發生消除,另一個與鹼作用消除,產物是相同的。此法可以用來控制產物烯烴的雙鍵構型。[4][9]
酸催化下,硅基與羥基處於反式的異構體生成E型為主的產物烯烴,處於順式的異構體生成Z型為主的烯烴;鹼催化下,反式異構體主要生成Z型烯烴,順式異構體主要生成E型烯烴。
參見[編輯]
參考資料[編輯]
- ^ D. J. Peterson. Carbonyl olefination reaction using silyl-substituted organometallic compounds. J. Org. Chem. 1968, 33 (2): 780–784. doi:10.1021/jo01266a061.
- ^ Birkofer, L.; Stiehl, O. Top. Curr. Chem. 1980, 88, 58.(綜述)
- ^ Ager, D. J. Synthesis 1984, 384-398.(綜述)
- ^ 4.0 4.1 Ager, D. J. Org. React. 1990, 38, 1-223.(綜述)
- ^ T. H. Chan. Alkene synthesis via β-functionalized organosilicon compounds. Acc. Chem. Res. 1977, 10 (12): 442–448. doi:10.1021/ar50120a003.
- ^ T. H. Chan and E. Chang. Synthesis of alkenes from carbonyl compounds and carbanions alpha to silicon. III. Full report and a synthesis of the sex pheromone of gypsy moth. J. Org. Chem. 1974, 39 (22): 3264–3268. doi:10.1021/jo00936a020.
- ^ X. Zeng, F. Zeng and E. Negishi. Efficient and Selective Synthesis of 6,7-Dehydrostipiamide via Zr-Catalyzed Asymmetric Carboalumination and Pd-Catalyzed Cross-Coupling of Organozincs. Org. Lett. 2004, 6 (19): 3245–3248. doi:10.1021/ol048905v.
- ^ E. J. Corey, D. Enders and M. G. Bock. A simple and highly effective route to α-β-unsaturated aldehydes. Tetrahedron Letters. 1976, 17 (1): 7–10. doi:10.1016/S0040-4039(00)71308-6.
- ^ Barrett, A. G. M.; Flygare, J. A.; Hill, J. M.; Wallace, E. M. (1998). "Stereoselective Alkene Synthesis via 1-Chloro-1-[(dimethyl)phenylsilyl]alkanes and α-(Dimethyl)phenylsilyl Ketones: 6-Methyl-6-dodecene". Org. Synth.; Coll. Vol. 9: 580.
