四氯化鉑
| 四氯化鉑 | |
|---|---|

| |
| 英文名 | Platinum(IV) chloride Platinum tetrachloride |
| 別名 | 氯化鉑(IV) |
| 識別 | |
| CAS號 | 13454-96-1 |
| PubChem | 26031 |
| ChemSpider | 19957150 |
| SMILES |
|
| InChI |
|
| InChIKey | KBPRWZWTZAMEIF-XBHQNQODAX |
| 性質 | |
| 化學式 | PtCl4 |
| 摩爾質量 | 336.89 g/mol g·mol⁻¹ |
| 外觀 | 棕紅色粉末 |
| 密度 | 4.303 g/cm3(無水) 2.43 g/cm3(五水) |
| 熔點 | 370 °C(643 K)(分解) |
| 溶解性(水) | 58.7 g/100 mL(無水) 易溶(五水) |
| 溶解性 | 可溶於丙酮,微溶於乙醇,難溶於乙醚(無水) 可溶於乙醇、乙醚(五水) |
| 磁化率 | −93.0·10−6 cm3/mol |
| 結構 | |
| 分子構型 | Square planar |
| 危險性 | |
| 歐盟分類 | 未列出 |
| 致死量或濃度: | |
LD50(中位劑量)
|
276 mg/kg (rat, oral) |
| 相關物質 | |
| 其他陰離子 | 四氟化鉑 四溴化鉑 四碘化鉑 |
| 其他陽離子 | 四氯化銥 |
| 相關化學品 | 二氯化鉑 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
四氯化鉑是一種無機化合物,化學式為PtCl4,為棕色固體,其中鉑為+4價。[1]
結構[編輯]
和典型的Pt(IV)化合物一樣,四氯化鉑的金屬中心採用八面體配位{PtCl6}。該幾何構型通過形成其中一半的氯橋配體在鉑中心之間橋接的聚合物來實現。其聚合物的結構僅在溶解時會破壞氯橋配體。因此,加入HCl得到H2PtCl6。順式的PtCl4L2的Pt(IV)的路易斯鹼加合物是已知的,大多數通過氧化Pt(II)的衍生物來製備。
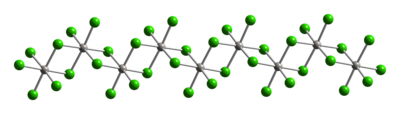 |
製備與化學性質[編輯]
PtCl4可從氯鉑酸的熱分解製備,而氯鉑酸由王水溶解金屬鉑得到:
- Pt + 4 HNO3 + 6 HCl → H2PtCl6 + 4 NO2 + 4 H2O
- H2PtCl6 → PtCl4 + 2 HCl↑
當過量的酸去除後,PtCl4從水溶液中結晶出大量的紅色的五水合物晶體PtCl4·5H2O,[2]它在300℃的乾燥氯氣流中加熱可以脫水。PtCl4·5H2O是其最穩定的形式,也是市售品的常見形式。
PtCl4和可溶性鹼反應,可以得到[Pt(OH)6]2−。甲基格氏試劑與其作用,伴隨着部分水解,PtCl4轉化為立方簇[Pt(CH3)3(OH)]4。[3]加熱PtCl4,釋放出氯,生成二氯化鉑:
- PtCl4 → PtCl2 + Cl2↑
鉑的四溴化物和四碘化物都是已知的。
參考文獻[編輯]
- ^ Cotton, S. A. Chemistry of Precious Metals, Chapman and Hall (London): 1997. ISBN 0-7514-0413-6.
- ^ George Samuel Newth. A text-book of inorganic chemistry. Longmans, Green, and co. 1920: 694 [2017-07-01]. (原始內容存檔於2019-08-15).
- ^ Greenwood, N. N.; & Earnshaw, A. (1997). Chemistry of the Elements (2nd Edn.), Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
拓展閱讀[編輯]
- 胡建華. 一種光譜純四氯化鉑的製備方法[P]. CN102030378A
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
