氟化氫
| 此條目需要補充更多來源。 (2021年3月19日) |
| 氟化氫 | |
|---|---|
| |

| |
| IUPAC名 Hydrogen fluoride | |
| 識別 | |
| CAS號 | 7664-39-3 |
| ChemSpider | 14214 |
| SMILES |
|
| InChI |
|
| InChIKey | KRHYYFGTRYWZRS-UHFFFAOYAC |
| ChEBI | 29228 |
| RTECS | MW7875000 |
| KEGG | C16487 |
| 性質 | |
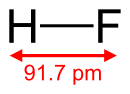
| 化學式 | HF |
| 摩爾質量 | 20.0063 g·mol⁻¹ |
| 外觀 | 無色氣體 |
| 密度 | 0.818 g/L |
| 熔點 | −83.38 C (189.77 K) |
| 沸點 | 19.54 °C (293.15 K) |
| pKa | 3.17(水) 15(DMSO)[1] |
| 危險性 | |
| 歐盟危險性符號 | |
| 警示術語 | R:R26/27/28-R35 |
| 安全術語 | S:S1/2-S7/9-S26-S36/37/39-S45 |
| 主要危害 | 劇毒、腐蝕性 |
| NFPA 704 | |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
氟化氫(化學式:)是氫的氟化物,有強烈的腐蝕性,有劇毒。它是無色的氣體,在空氣中,只要超過3ppm就會產生刺激的味道。
氫氟酸是氟化氫的水溶液,可以透過皮膚黏膜、呼吸道及腸胃道吸收。若不慎暴露於氫氟酸,應立即用六氟靈(Hexafluorine)沖洗,若現場無六氟靈,則先以大量清水沖洗20至30分鐘,然後以葡萄糖酸鈣軟膏或藥水塗抹,並緊急送醫處理[2];若不小心誤飲,則要立即喝下大量的高鈣牛奶,然後緊急送醫處理。
異常特性[編輯]
氟化氫相對於其他鹵素氫化物具有一些異常的物理特性和化學特性。
高熔點及沸點[編輯]
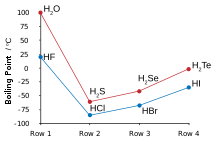
由於氟原子電負性很大,所以會與氫原子形成氫鍵,所以沸點較氯化氫、溴化氫、碘化氫等為高。
弱酸性[編輯]
氫氟酸之水溶液是一種弱酸。一方面由於氟原子半徑小,電荷密度高,對氫原子的束縛較大,另一方面由於H-F共價鍵高度極性,故氟化氫具有分子間氫鍵,使得氟化氫具有高度化學穩定性,離解度非常低。因此,離解生成之水合氫離子濃度較低,使酸度常數Ka較低。由此氟化氫為弱酸。
酸度變化[編輯]
其他鹵化氫於水中濃度增加,酸度會下降。
對於一般氫鹵酸,鹵化氫濃度上升至某個程度,每單位體積溶液中之含水量急劇下降,令此反應之平衡位置趨向左邊,使離解度下降,酸性下降。但在較濃的氟化氫水溶液中,酸度反而會增加。此現象是由於氟離子之一個反應:
對於氫氟酸,若氟化氫濃度增加,以上反應之平衡位置趨向右邊,使氟離子濃度上升。
根據勒沙特列原理,此化學平衡之平衡位置趨向右邊以傾向增加氟離子之濃度,故此離解度上升,酸性上升。
侵蝕玻璃性[編輯]
氫氟酸本身對矽酸鹽(硅)及二氧化矽有極強的侵蝕能力。 故可腐蝕玻璃(主要成分是二氧化矽及矽酸鹽),是可腐蝕玻璃的酸,所以日常貯存要使用塑料瓶或鉛製容器。
作為溶劑[編輯]
氟化氫是強酸性溶劑,在氟化氫中:
一價的氟化物均易溶於氟化氫;二價的氟化物、、溶解度稍大,、、溶解度稍小;三價的氟化物溶解度稍小;其餘二至四價金屬的氟化物均難溶。
一些低價過渡金屬的氟化物可以將溶劑還原,如和,將溶劑還原,放出氫氣,自身被氧化為和。
在酸性環境下,氫氟酸非常危險,因為氫離子在酸性環境下會腐蝕皮膚,而氟離子則會將體內的鈣,鎂離子溶出,將嚴重破壞生理平衡。
參考文獻[編輯]
- ^ pKa's of Inorganic and Oxo-Acids. D. H. Ripin, D. A. Evans. [2020-03-09]
- ^ 六氟靈使用法則. 永百實業股份有限公司. [2019-08-29]. (原始內容存檔於2019-08-29).
參見[編輯]
| |||||||





















