受體 (生物化學)
| 此條目需要編修,以確保文法、用詞、語氣、格式、標點等使用恰當。 (2023年8月11日) |

受體(receptors),又稱受器、接收器,是一個生物化學上的概念,指一類能傳導細胞外信號,並在細胞內產生特定效應的分子。產生的效應可能僅在短時間內持續,比如改變細胞的代謝或者細胞的運動。也可能是長效的效應,比如上調或下調某個或某些基因的表達[1][2][3]。
受體通過與特定的配體結合而感知到細胞外的信號。隨後,受體的結構發生變化,並誘導細胞內產生相應的效應。受體通過信號級聯效應,逐步以指數級擴大細胞內產生的效應的強度。信號級聯的第一步可能是產生cAMP等第二信使分子,誘導下一級反應[3]。根據受體所在的位置,可以分爲細胞表面受體和細胞內受體兩類。其中細胞表面受體位於細胞表面,處於內環境中的配體可以直接與之結合。大部分的細胞內受體都屬於核受體。在未與配體結合時,這些受體位於細胞質中,配體需要穿過細胞膜進入細胞內,才能與該受體結合。在與配體結合後,核受體會轉入細胞核中發揮效應。另一類細胞內受體是細胞內的酶、RNA、核糖體等,配體通過與這些受體結合發揮效應[4][5]。
細胞表面受體[編輯]
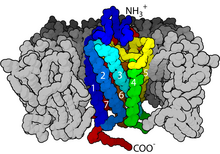
細胞表面受體是一類位於細胞表面的受體,可與細胞外的配體結合結合,並引發細胞內的反應。目前已發現的細胞表面受體中,較經典的有5類:G蛋白偶聯受體(G protein-coupled receptor)、受體酪胺酸激酶(Receptor tyrosine kinases)、鳥苷酸環化酶偶聯受體(Guanylate cyclase-coupled receptor)、離子通道(ion channel),以及黏附受體(adhesion receptor),其中以G蛋白偶連受體的數量最多,相關的研究也是最深入的,諾貝爾化學獎以及諾貝爾生理醫學獎都有授予給G蛋白偶聯受體的研究者的紀錄[6][7][3][8]。
G蛋白偶聯受體[編輯]
G蛋白偶聯受體是目前發現最主要的一種細胞表面受體,對它的研究也是最透徹的。G蛋白偶聯受體可分爲A-F六類,不同分類之間並沒有顯著的同源關係[9][10][11][12]。G蛋白偶聯受體的一個特徵是,它有一個穿膜7次結構域的受體,肽鏈的N端位於細胞外側,C端則位於細胞內。另一個特徵則是該受體與G蛋白偶聯。G蛋白通常含有三個亞基α、β、γ,其中α亞基靜息狀態下與GDP結合。當受體被配體活化後,受體會使與G蛋白結合的GDP轉化爲GTP,從而使G蛋白活化,α亞基分離,引起下一步反應,通過肌醇三磷酸(IP3)、cAMP等第二信使引發下一級反應[3][8]。
受體酪胺酸激酶[編輯]
受體酪胺酸激酶是一類有著單次穿膜結構域的受體,在細胞內側偶聯著酪胺酸激酶。當該類受體活化後,內側的酪胺酸激酶會發生活化,對蛋白肽鏈上的酪胺酸(Tyr)進行磷酸化,進而產生下一步效應。胰島素受體、IGF1R,以及IGF2R都屬於受體酪胺酸激酶[13][14][8]。
鳥苷酸環化酶偶聯受體[編輯]
鳥苷酸環化酶偶聯受體(Guanylate cyclase-coupled receptor),亦稱爲受體鳥苷酸環化酶(Receptor guanylate cyclase),是一種單次穿膜的細胞表面受體,該受體因爲可在活化後將鳥苷酸環化爲cGMP,以cGMP分子作爲第二信使而得名。在人體內,因爲不同組織中鳥苷酸環化酶偶聯受體的類型不同,這類受體的具體功能也不同。腎臟中的心房排鈉肽(ANF)受體NRP1、NRP2、NRP3就屬於鳥苷酸環化酶偶聯受體。另外,亦存在位於細胞內的鳥苷酸環化酶偶聯受體,比如可溶性一氧化氮活化鳥苷酸環化酶(soluble NO-activated guanylate cyclase)[8][15]。
離子通道[編輯]
離子通道是一類位於細胞表面的蛋白,平時屬於關閉狀態,離子不能通過,在被活化後,通道才會打開,離子方可通過離子通道轉移到細胞膜另一側。一類離子通道,即配體門控離子通道(Ligand-gated ion channel)可在與配體結合後活化,使對應的離子得以通過。神經突觸中突觸後膜上的毒蕈鹼受體就是一類配體門控離子通道,在與乙醯膽鹼結合後,會打開離子通道,允許鈣離子(Ca2+)、鈉離子(Na+)內流,引發突觸後膜興奮[16][17][18]。
黏附受體[編輯]
黏附受體(adhesion receptor)是一類與細胞黏附相關的受體,主要接收與細胞黏附的信號。細胞膜上的整合素就是一種黏附受體。整合素在細胞外會與配體膠原蛋白、硫酸乙醯肝素等結合,而細胞內的結構域則是與細胞骨架結合(結合可能是直接結合,也可能由talin蛋白等作爲連接的中間體),通過感知細胞外膠原蛋白等的變化,調節細胞內的細胞極性、細胞生長存活狀態,以及基因表現強度等,同時,整合素也可以反過來對細胞外產生影響,如調節細胞黏附和遷移,以及細胞外受質的聚合[8]。
細胞內受體[編輯]

位於細胞內的受體稱爲細胞內受體。大部分的細胞內受體是核受體,在未活化時位於細胞質中。因爲配體需要穿過細胞膜,擴散入細胞質中後才可以與核受體結合,因而核受體的配體大部分是小分子脂類物質。核受體在與配體結合後,會進入細胞核內,對基因的表達進行調控,因而核受體可認爲是一類轉錄因子。因爲核受體的效應是改變基因表現,因而相比細胞表面受體,核受體產生效應所需時間相對較長,同時產生的效應相對也能持續較長時間[19][20][5]。
除核受體外,還有一類細胞內受體的化學本質是細胞內的酶、結構性蛋白、核糖體或RNA。比如藥物(配體)甲氧苄氨嘧啶可以作用於受體微管、紅黴素可以作用於細菌的50s核糖體亞基[5]。
信號級聯[編輯]
受體在接受胞外信號後,會向細胞內傳遞信號。在這個過程中,信號通過不斷向下一級傳遞的方式逐漸增大,這個過程稱爲信號級聯。雖然受體最初只能產生小部分的效應分子,但每個效應分子又能活化幾個下一級的傳訊分子,這樣,一個受體的信號會以指數級的方式不斷擴大,最後在細胞內產生明顯的效應,比如使數個基因的表達發生變化。一些受體在活化後會產生一些效應分子,如cAMP等,並由這些分子開始信號級聯反應,這樣的分子稱爲第二信使[21][22][8]。
受體脫敏[編輯]

受體脫敏(desensitization)是指受體在反覆受到配體刺活化化後,對配體反應的敏感性的強度下降的現象。在藥理學中,快速抗藥即由受體脫敏造成。受體脫敏的一種機制是,受體通過內吞作用被運回細胞內部,使細胞表面的受體數量減少,能與內環境中配體結合的受體也就減少。此外,一部分受體,如一些離子通道,在活化後需要經過一定的靜息期方可再次被活化[5][8]。 細胞對外界信號作出適度的反應既涉及信號的有效刺激和啟動,也依賴於信號的接觸與細胞的反應終止。而解除與終止信號的重要方式,就是細胞使受體脫敏。這是一種負反饋調控機制。 概括起來,靶細胞對傳訊分子的脫敏機制有如下5種方式: (1)受體沒收:細胞通過配體依賴性的受體介導的內吞作用減少細胞表面可利用受體的數目,以網格蛋白/AP包被膜泡的形式攝入細胞,內吞泡脫包被形成無包被的早期胞內體,受體被暫時扣留,受pH降低的影響(pH5.0)受體-配體複合物在晚期胞內體解離,扣留的受體可返回質膜再利用(如LDL受體),配體進入溶體被消化。這是細胞對多種肽類或其他激素受體發生脫敏反應的一種基本途徑。有時即使缺乏配體結合的情況下,細胞通過批量膜流也會使細胞表面受體以相對較低的速率被內化,然後再循環利用,從而減少細胞表面可利用受體的數目。 (2)受體下調:通過受體介導的內吞作用,受體-配體複合物轉移到胞內溶體消化降解而不能重新利用,因此細胞通過表面自由受體數目減少和配體的清除導致細胞對信號敏感性下調。 (3)受體失活:通過信號通路將受體進行一些修飾從而讓其失活,這是一種快速的受體脫敏機制。以視桿細胞對周圍光強度變化的適應為例,由光活化的視蛋白是視紫紅質激酶的受質,活化的視蛋白其胞質面3個絲胺酸殘基恰是視紫紅質激酶的磷酸化位點。視蛋白的磷酸化一方面顯著降低視蛋白分子活化G蛋白α亞基的能力,另一方面視蛋白胞質面磷酸-絲胺酸位點為胞質抑制蛋白β-arrestin的結合提供了錨定位點,β-arrestin的結合完全阻斷G蛋白α亞基與磷酸化的視蛋白的相互作用,從而關閉所有視桿細胞的活性。這種引發靶細胞對信號刺激的脫敏機制也是其他G蛋白偶聯受體在高配體水平條件下引發脫敏反應的普遍機制,導致受體磷酸化的激酶包括PKA、PKC和G蛋白偶聯受體激酶(GRK)家族。GRK只結合已經被活化的受體,使其C端胞質域特定胺基酸殘基磷酸化,從而結合β-arrestin,這是G蛋白偶聯受體脫敏的重要方式之一。 (4)信號蛋白失活:受體本身不受影響,但級聯反應中細胞內的信號蛋白受阻,不能誘導正常的細胞反應。 (5)抑制蛋白產生:受體被活化之後,在下游的反應中產生異質性的蛋白,形成負反饋環從而阻止之後的訊息傳遞過程。 [23]
學說發展史[編輯]
1878年,約翰·牛波特·朗勒提出了最早的受體假設,他用「受體物質」來解釋阿托品和毛果芸香鹼對貓唾液分泌的拮抗作用。1913年,保羅·埃爾利希根據實驗結果提出了「鎖和鑰匙」的藥物與受體的互補關係,但當時認為受體和配體都是靜止不動的。1933年,阿爾弗雷德·約瑟夫·克拉克在研究藥物對蛙心的量效關係中,定量的闡明了藥物於受體的相互作用。這些說法為受體學說奠定了基礎。[24]
20世紀50-60年代,阿里恩斯和史蒂芬森(R P 'Steve' Stephenson)從實驗發現藥物產生最大效應不一定占領全部受體,由此提出的備用受體學說和速率學說,從動力學的角度解釋了受體拮抗劑和促效劑的作用。[24]
20世紀70年代以後,隨著蛋白質晶體學的發展,許多配體和受體的結構被人們所認識,從而闡明了受體亞型、離子通道等的分布和功能。變構學說徹底打破了蛋白質靜止不動的認識,認為受體在有活性與無活性的構象狀態間轉化。1977年,格里夫斯(Greaves)提出的能動受體學說,把受體的微觀變化同生理、生化或藥理反應相聯繫,說明了受體在細胞膜內傳遞資訊的作用機制。[24]
參考[編輯]
- ^ Hall, JE. Guyton and Hall Textbook of Medical Physiology. Philadelphia, PA: Elsevier Saunders. 2016: 930–937. ISBN 978-1-4557-7005-2.
- ^ Alberts, Bruce; Bray, Dennis; Hopkin, Karen; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walter, Peter. Essential Cell Biology Fourth. New York, NY, USA: Garland Science. 2014: 534. ISBN 978-0-8153-4454-4.
- ^ 3.0 3.1 3.2 3.3 Harvey Lodish; et al. Chapter 15. Molecular Cell Biology (7th edition). Macmillan Higher Education. 2013: 674–683. ISBN 978-1-4641-0981-2.
- ^ Rang HP, Dale MM, Ritter JM, Flower RJ, Henderson G. Rang & Dale's Pharmacology 7th. Elsevier Churchill Livingstone. 2012. ISBN 978-0-7020-3471-8.
- ^ 5.0 5.1 5.2 5.3 Michelle A. Clark; et al. Pharmacology 5th. 北京大學醫學出版社. 2013: 26–36. ISBN 978-7-5659-0620-6.
- ^ The Nobel Prize in Physiology or Medicine 1994. Nobel Foundation. [2007-07-28]. (原始內容存檔於2007-07-18).
- ^ Royal Swedish Academy of Sciences. The Nobel Prize in Chemistry 2012 Robert J. Lefkowitz, Brian K. Kobilka. 2012-10-10 [2012-10-10]. (原始內容存檔於2012-10-12).
- ^ 8.0 8.1 8.2 8.3 8.4 8.5 8.6 David L. Nelson; Michael M. Cox; et al. Lehninger Priciples of Biochemistry 6th. New York: W. H. Freeman and Company. 2013: 436-484. ISBN 978-1-4292-3414-6.
- ^ Attwood TK, Findlay JB. Fingerprinting G-protein-coupled receptors. Protein Eng. 1994, 7 (2): 195–203 [2018-05-22]. PMID 8170923. doi:10.1093/protein/7.2.195. (原始內容存檔於2007-10-12).
- ^ Kolakowski LF Jr. GCRDb: a G-protein-coupled receptor database. Receptors Channels. 1994, 2 (1): 1–7. PMID 8081729.
- ^ Foord SM, Bonner TI, Neubig RR, Rosser EM, Pin JP, Davenport AP, Spedding M, Harmar AJ. International Union of Pharmacology. XLVI. G protein-coupled receptor list. Pharmacol Rev. 2005, 57 (2): 279–88. PMID 15914470. doi:10.1124/pr.57.2.5.
- ^ InterPro. [2018-05-22]. (原始內容存檔於2008-02-21).
- ^ Robinson DR, Wu YM, Lin SF. The protein tyrosine kinase family of the human genome. Oncogene. November 2000, 19 (49): 5548–57. PMID 11114734. doi:10.1038/sj.onc.1203957.
- ^ Ségaliny et al. (2015) "Receptor tyrosine kinases: Characterisation, mechanism of action and therapeutic interests for bone cancers". Bone Oncology 23;4 (1):1-12.[1] (頁面存檔備份,存於網際網路檔案館) Retrieved on 2017-09-17
- ^ George J. Siegel; R. Wayne Albers. Basic neurochemistry: molecular, cellular, and medical aspects. Academic Press. 2006: 368– [2010-12-16]. ISBN 978-0-12-088397-4.
- ^ Gene Family: Ligand gated ion channels. HUGO Gene Nomenclature Committee. [2018-05-22]. (原始內容存檔於2017-11-14).
- ^ 道蘭氏醫學詞典中的ligand-gated channel
- ^ Purves, Dale, George J. Augustine, David Fitzpatrick, William C. Hall, Anthony-Samuel LaMantia, James O. McNamara, and Leonard E. White. Neuroscience. 4th ed.. Sinauer Associates. 2008: 156–7. ISBN 978-0-87893-697-7.
- ^ Evans RM. The steroid and thyroid hormone receptor superfamily. Science. May 1988, 240 (4854): 889–95. PMID 3283939. doi:10.1126/science.3283939.
- ^ Olefsky JM. Nuclear receptor minireview series. The Journal of Biological Chemistry. October 2001, 276 (40): 36863–4. PMID 11459855. doi:10.1074/jbc.R100047200.
- ^ Lalli E, Sassone-Corsi P. Signal transduction and gene regulation: the nuclear response to cAMP. The Journal of Biological Chemistry. Jul 1994, 269 (26): 17359–62. PMID 8021233.
- ^ Rosen OM. After insulin binds. Science. Sep 1987, 237 (4821): 1452–8. Bibcode:1987Sci...237.1452R. PMID 2442814. doi:10.1126/science.2442814.
- ^ 定量細胞生物學(第4版),翟中和
- ^ 24.0 24.1 24.2 李端 殷明. 藥理學. 人民衛生出版社. 11-15. ISBN 978-7-117-08905-0
參見[編輯]
外部連結[編輯]
- IUPHAR GPCR Database and Ion Channels Compendium(頁面存檔備份,存於網際網路檔案館)
- Human plasma membrane receptome
- 醫學主題詞表(MeSH):Cell+surface+receptors
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
