氯化亞銅
| 氯化亞銅 | |
|---|---|

| |

| |
| IUPAC名 Copper(I) chloride 氯化銅(I) | |
| 識別 | |
| CAS編號 | 7758-89-6 |
| PubChem | 62652 |
| ChemSpider | 56403 |
| SMILES |
|
| InChI |
|
| InChIKey | OXBLHERUFWYNTN-REWHXWOFAC |
| EINECS | 231-842-9 |
| ChEBI | 53472 |
| RTECS | GL6990000 |
| 性質 | |
| 化學式 | CuCl |
| 莫耳質量 | 98.99 g·mol⁻¹ |
| 外觀 | 純品為白色粉末,氧化帶有綠色 |
| 密度 | 4.140 g/cm3 (固) |
| 熔點 | 430 °C (703 K) |
| 沸點 | 1490 °C (1760 K) 分解 |
| 溶解性(水) | 0.0062 g/100 mL (20 °C) |
| 溶解性 | 不溶於乙醇和丙酮;溶於濃HCl和NH4OH |
| 折光度n D |
1.930[1] |
| 結構 | |
| 晶體結構 | 四面體最密堆積 閃鋅礦結構 |
| 危險性 | |
| 警示術語 | R:R22, R50/53 |
| 安全術語 | S:S2, S22, S60, S61 |
| MSDS | ScienceLab.com |
| 歐盟編號 | 029-001-00-4 |
| 歐盟分類 | 有害(Xn) 對環境會造成危害(N) |
| 主要危害 | 刺激性 |
| NFPA 704 | |
| 閃點 | 不燃 |
| 相關物質 | |
| 其他陰離子 | 溴化亞銅,碘化亞銅 |
| 其他陽離子 | 氯化銅,氯化銀 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |

氯化亞銅是銅(I)的氯化物,化學式為CuCl。氯化亞銅為白色固體,常作為製取其他銅化合物的原料。和其他第一列過渡元素的鹵化物不同,它可以和一氧化碳形成穩定的錯合物。由於銅(I)常形成四面體型錯合物,因此氯化亞銅晶體結構為閃鋅礦型的。它是難溶於水的白色固體,易溶於濃鹽酸,不純的氯化亞銅樣品因混有氯化銅而現綠色[2]。
歷史[編輯]
氯化亞銅是由羅伯特·波以耳在17世紀中葉通過氯化汞和金屬銅反應首先合成的[3] :
- HgCl2 + 2 Cu → 2 CuCl + Hg
1799年約瑟夫·普魯斯特鑑別出了兩種不同的銅的氯化物。他通過將氯化銅在隔絕空氣的條件下加熱至紅熱使它失去一半的氯原子,隨後用水洗去剩餘的氯化銅得到產物[4]。
酸性的氯化亞銅溶液曾用於分析測定氣體中的一氧化碳含量,比如用於亨普爾氣體發生器(Hempel's gas apparatus)[5][6]。
化學性質[編輯]
-
附著在銅絲上的白色氯化亞銅晶體
-
被空氣部分氧化的氯化亞銅
相較於其他路易士酸,氯化亞銅較容易取得,毒性也較低。此外,銅的氧化態較多,其中重要的包括+1、+2。氯化亞銅的性質大多與以上兩點有關。依照軟硬酸鹼理論的分類,氯化亞銅為「軟酸」,因此較容易和其他歸類為「軟鹼」的路易士鹼形成穩定的錯合物。以下是氯化亞銅和三苯基膦的反應:
- CuCl + P(C6H5)3 → [CuCl(P(C6H5)3)]4
CuCl不溶於水,但可溶於一些特定的溶液中。它與鹵化物離子加合生成錯離子,例如溶解在濃鹽酸中時生成H3O+CuCl2−。含CN−、S2O32−和NH3的溶液也可與CuCl配合而溶解。它也溶於氯化鉀或氯化鈉等氯化物的濃溶液中。
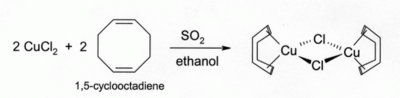
CuCl在HCl或NH3中的溶液可吸收一氧化碳生成無色的錯合物,比如以氯作為橋接配位基的二聚體[CuCl(CO)]2。而且其鹽酸溶液也可與乙炔反應生成[CuCl(C2H2)],氯化亞銅的氨溶液時則與乙炔反應得到爆炸性的乙炔亞銅(Cu2C2)。CuCl與烯烴的錯合物可在溶有烯烴的醇溶液中,用二氧化硫還原CuCl2製得,其中氯化亞銅與二烯烴,如1,5-環辛二烯的錯合物相當穩定:[7]
它在水中溶解度不高,而且水溶液不穩定容易歧化,產物為Cu和CuCl2。[8]因此其溶液常帶綠色(如右上圖)。
乾燥的氯化亞銅在空氣中比較穩定,但濕的氯化亞銅在空氣中易發生水解和被空氣氧化。
- 4CuCl + O2 + 4H2O → 3CuO·CuCl2·3H2O + 2HCl
- 8CuCl + O2 → 2Cu2O + 4Cu2+ + 8Cl-
氯化亞銅和溴反應,可以得到暗棕色的氯溴化銅(II)(CuBrCl),易溶於水。[9]
製備[編輯]
實驗室製法[編輯]
實驗室製備氯化亞銅可以往熱的氯化銅的濃鹽酸中加銅屑的方法,再加熱溶液至深棕色,稀釋後即得氯化亞銅沉澱。
另一種製備方法是向含有銅絲、硝酸、氯化銨、鹽酸的溶液中通入氧氣並加熱,此反應中硝酸為催化劑:
- 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
- 2NO + O2 → 2NO2
- 3NO2 + H2O → 2HNO3 + NO
- Cu(NO3)2 + Cu + 2HCl + 2NH4Cl → 2NH4[CuCl2] + 2HNO3
反應結束後,向容器中加入大量水稀釋便得氯化亞銅沉澱。[10]
工業製法[編輯]
工業上合成氯化亞銅有多種方法。
例如硫酸銅法,向硫酸銅和氯化鈉的溶液中通入二氧化硫,再用大量的水稀釋。最後洗滌、乾燥,即得氯化亞銅產品。反應中溫度宜控制在70~80°C,一定要加入過量的氯化鈉。初產品要迅速洗滌乾燥,以保證產品的產量和質量。
用途[編輯]
氯化亞銅的主要用途是作為製取殺真菌劑氯氧化銅(王銅)的前體。為達此目的,先利用歸中反應製得氯化亞銅水溶液,再以空氣氧化:
- Cu + CuCl2 → 2 CuCl
- 6 CuCl + 3/2 O2 + 3 H2O → 2 Cu3Cl2(OH)4 + CuCl2
氯化亞銅可作為很多有機反應的催化劑。氯化鋁存在下,它可吸收一氧化碳,被用在合成氨工業上。
有機合成[編輯]
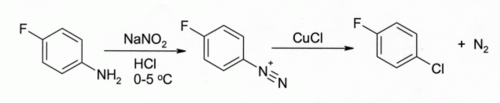
在桑德邁爾反應中,[11]以氯化亞銅處理芳香重氮鹽,可得到氯代芳烴:
該反應應用很廣,產率很高。
早期曾以鹵化亞銅來催化格氏試劑對ɑ,β-不飽和酮的1,4-加成,[12]並從此研究出當今在有機合成中應用很廣的有機銅試劑:[13]
例如,CuCl與甲基鋰(CH3Li)反應得到吉爾曼試劑——(CH3)2CuLi,常用於有機合成中。這與有氯化亞銅的格氏試劑與α,β-不飽和醛酮的反應類似。儘管碘化亞銅之類的銅(I)化合物也被用於這些反應中,但有些情況下還是選擇氯化亞銅:[14]
Bu = 正丁基
但在無CuCl存在時,格氏試劑與α,β-不飽和醛酮反應會得到1,2-與1,4-加成產物的混合物,其情況與α,β-不飽鍵關於羰基另一邊的基團有關:當基團為H(即醛基)或較小時,生成的是1,2-加成為主;當基團較大時,生成的是1,4-加成為主
在加特曼-科赫反應之中,作為催化劑,氯化亞銅吸收氣態的一氧化碳。
在瓦克爾法中,氯化亞銅是反應中由氯化銅形成的中間產物。
聚合物[編輯]
參考文獻[編輯]
- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^ Method for preparing cupric ion-free cuprous chloride (PDF). www.freepatentsonline.com. [2022-11-08]. (原始內容存檔 (PDF)於2022-11-08).
- ^ Boyle, Robert. Considerations and experiments about the origin of forms and qualities. Oxford. 1666. As reported in Mellor.
- ^ Proust, J. L. Ann. Chim. Phys. (1). 1799, 32: 26. 缺少或
|title=為空 (幫助) - ^ Martin, Geoffrey. Industrial and Manufacturing Chemistry Part 1, Organic. London: Crosby Lockwood. 1917: 330–31.
- ^ Richards, Theodore William. Modifications of Hempel's Gas-Apparatus. Proceedings of the American Academy of Arts and Sciences. 1901, 37 (10) [2022-11-08]. ISSN 0199-9818. JSTOR 20021663. doi:10.2307/20021663. (原始內容存檔於2022-11-08).
- ^ Nicholls, D. Compleses and First-Row Transition Elements, Macmillan Press, London, 1973.
- ^ Greenwood, N.N.; Earnshaw, A. Chemistry of the Elements, 2nd ed.. Butterworth-Heinemann, Oxford, UK. 1997.
- ^ Batsanov, S. S.; Zalivina, E. N.; Derbeneva, S. S.; Borodaevskii, V. E. Synthesis and properties of copper bromo- and iodochlorides(俄文). Doklady Akademii Nauk SSSR, 1968. 181 (3): 599-602.
- ^ 黃宗明. 硝酸催化氧化法制备氯化亚铜的研究. 《無機鹽工業》. 2003-03, 35 (2): 40–41 [2016-03-24]. (原始內容存檔於2016-04-04).
- ^ (a) Wade, L. G. Organic Chemistry, 5th ed., p. 871, Prentice Hall, Upper Saddle RIver, New Jersey, 2003. (b) March, J. Advanced Organic Chemistry, 4th ed., p. 723, Wiley, New York, 1992.
- ^ Kharasch, M. S.; Tawney, P. O. Factors Determining the Course and Mechanisms of Grignard Reactions. II. The Effect of Metallic Compounds on the Reaction between Isophorone and Methylmagnesium Bromide. Journal of the American Chemical Society. 1941-09, 63 (9) [2022-11-08]. ISSN 0002-7863. doi:10.1021/ja01854a005. (原始內容存檔於2022-11-08) (英語).
- ^ Jasrzebski, J. T. B. H.; van Koten, G. in Modern Organocopper Chemistry, (N. Krause, ed.), p. 1, Wiley-VCH, Weinheim, Germany, 2002.
- ^ (a) Bertz, S. H.; Fairchild, E. H. in Handbook of Reagents for Organic Synthesis, Volume 1: Reagents, Auxiliaries and Catalysts for C-C Bond Formation, (R. M. Coates, S. E. Denmark, eds.), pp. 220-3, Wiley, New York, 1999. (b) Munch-Petersen, J., et al., Acta Chimica Scand., 15, 277 (1961).
外部連結[編輯]
| ||||||||||||||||||||||||||||||||||||