精子发生

精子发生(英語:spermatogenesis)是指有性生殖的雄性动物的生殖细胞在睾丸中的生精小管中发育为单倍体精子的过程。这一过程始于附着在生精小管基底膜的生殖细胞的有丝分裂[1]。这些生殖细胞被称为精原细胞。精原细胞分为增加生殖细胞数量的 A 型精原细胞和将要分化为初级精母细胞的 B 型精原细胞。人类的精原细胞(A0)经历七次有丝分裂(A1-A4、中间型、B 型)分化为初级精母细胞。初级精母细胞减数分裂(第一次减数分裂)为两个次级精母细胞,次级精原细胞分别减数分裂(第二次减数分裂)为两个相同的单倍体精子细胞(spermatid),之后进一步成熟为精子[2]。精子细胞分化、变态、成熟的过程称为精子形成(spermiogenesis)。一个 B 型精原细胞通过上述过程产生四个单倍体的精子[3]。
精子发生是有性生殖的重要环节,适当的环境条件是精子发生正常进行的关键。DNA 甲基化和组蛋白修饰在精子生成过程中发挥调控作用[4]。精子发生开始于青春期,之后一般终身持续进行,但随着年龄增长,产生的精子数量可能会有小幅降低(参见男性不育)。
精子发生起始于生精小管基底膜,细胞分裂、分化、成熟的同时沿生精小管移动并逐渐向内部迁移,最终向管腔释放成熟的精子。精子发生过程中的分裂具有同步性,使生精小管的横断面呈现出不同发育阶段对应的特定时相。生精小管上不同发育阶段的细胞形成的一段横切面的连续时相变化被称为生精上皮周期[5]。
意义[编辑]
精子发生过程产生成熟的雄性配子,即精子。在有性生殖过程中,精子与雌性配子(卵细胞)结合使其受精。受精过程中,两个单倍体的配子分别提供正常个体一半数量的染色体,重新组合成二倍体的受精卵。染色体数目改变通常会造成严重的胚胎发育障碍,为了保持后代染色体数量的稳定,配子的染色体数量必须减半。精子发生中的染色体数目异常可以引起人类的胚胎自然流产、先天性发育缺陷和认知障碍疾病(如唐氏综合征、克氏综合征)。

场所[编辑]
精子发生的起始阶段发生在睾丸中,之后逐渐转移至附睾,发育中的配子细胞在附睾中成熟,并储存直到射精排出。睾丸中的生精小管是精子发生的起点,生精小管内壁上的精原细胞朝着中心分裂——从内壁逐渐迁移至管腔——来产生未成熟的精子[2],之后在附睾中成熟。精子生成通常需要在低于体温 1-8°C 的较低温度下才能产生具有活性的精子,因此精子发生的场所(睾丸/阴囊)所处的温度调节十分重要[6]。不过,临床上发现小幅的温度波动(如使用运动护裆带来的温度变化)对精子的活力和数量没有负面影响[7]。
周期[编辑]
根据不同的测定方法,人类精子发生周期的时间估算从 74 天(以氚标记活检测定)[8][9]到 120 天(以表观遗传时钟测定)[10]不等。如果计入精子在生精小管中转运所需的时间,精子的形成大约需要三个月。男性的(一对)睾丸每天能产生 200 ~ 300 百万个精细胞[11],但其中只有约一半(即 100 百万)可以形成具有活力的精子[12]。
阶段[编辑]
人类精子发生的过程可以根据细胞类型划分为数个阶段。下表中除初级精母细胞中“倍性/ DNA 拷贝数/染色体数量”是 DNA 复制后、细胞分裂前的计数外,其他细胞的计数是指在 DNA 复制和细胞分裂之前的计数(即 G1 期)。
| 细胞类型 | 倍性/染色体数量(人类) | DNA拷贝数/染色单体数量(人类) | 进入下一阶段所经历的过程 |
| 精原细胞 (Ad 型、Ap 型和 B 型) | 二倍体 (2N) / 46 | 2C / 46 | 精母细胞发生(有丝分裂) |
| 初级精母细胞 | 二倍体 (2N) / 46 | 4C / 46 | 精细胞发生(第一次减数分裂) |
| 2个次级精母细胞 | 单倍体 (N) / 23 | 2C / 46 | 精细胞发生(第二次减数分裂) |
| 4个精细胞 | 单倍体 (N) / 23 | 1C / 23 | 精子形成 |
| 4个精子 | 单倍体 (N) / 23 | 1C / 23 | 精子释放 |
精母细胞发生[编辑]
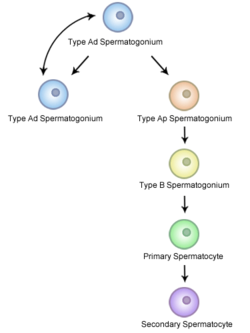
雄性配子发生的过程被称为精母细胞发生。在这一过程中,位于生精小管的基底室(basal compartment)的精原细胞发生有丝分裂,形成两个二倍体的中间体,称为初级精母细胞。初级精母细胞迁移至生精小管的近腔室(adluminal compartment)进行 DNA 复制,然后发生第一次减数分裂,产生两个单倍体的次级精母细胞,接着发生第二次减数分裂产生单倍体的精细胞。精母细胞发生的过程通过染色体联会和同源染色体重组增加配子的遗传多样性。DNA 损伤应答(DDR)是精母细胞发生中的重要机制。DNA 损伤修复的关键蛋白 FMRP 在精母细胞发生的减数分裂过程中结合在染色体上调控 DNA 损伤应答[13]。
精母细胞发生中细胞进行不完全分裂,子代细胞通过细胞质间桥相连,使细胞发育的状态同步化。精原细胞不断通过有丝分裂补充自身的数量,为精母细胞发生提供持续的精原细胞供应,确保不断进行的精母细胞发生不会耗尽睾丸中的精原细胞[14]。
精细胞发生[编辑]
精细胞生成是次级精母细胞产生精细胞的过程。精母细胞发生中产生的次级精母细胞迅速进入第二次减数分裂产生单倍体的精细胞。这一阶段十分短暂,因此在组织切片中很难观察到次级精母细胞。
精子形成[编辑]
在精子形成阶段中,精细胞的一个中心粒上的微管延伸形成尾部,延伸出的微管形成轴丝,相应的中心粒形成毛基体,从而使中心体减半[15]。线粒体围绕轴丝的前端(中段)排列使其变粗,为精子尾部摆动供能。精细胞延伸的同时,DNA 首先与特定的碱性核蛋白结合,之后逐步替换为与精蛋白紧密结合,包装为高度浓缩、失去转录活性的染色质。包裹浓缩细胞核的高尔基体形成顶体。
在睾酮的诱导下精细胞进一步成熟,除去残余的胞浆和细胞器。排出的胞浆也称为残余体,将由周围的支持细胞通过胞吞作用吸收。此阶段的成熟精细胞还不具有运动能力。成熟的精细胞从支持细胞上释放到生精小管的管腔中的过程称为精子释放。
在生精小管的蠕动帮助下,不具运动能力的成熟精细胞随支持细胞分泌的睾丸液转运至附睾中。成熟精细胞在附睾中获得运动能力,成为具有授孕能力的精子。但精子并不依靠自身的游动通过男性生殖系统的剩余部分,而是借由肌肉收缩被排出体外。
支持细胞的作用[编辑]
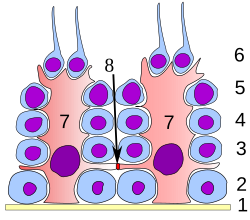
塞尔托利氏细胞又称支持细胞。支持细胞为精子发生过程提供结构性和营养的支持作用。在精子发生的各个阶段,生精细胞都与支持细胞保持紧密接触。每一个支持细胞的都从生精小管的基底膜延伸至管腔,但这一结构在光镜下通常难以分辨。
支持细胞在精子发生过程中发挥多种功能,它们以下列方式支持配子的发育:
- 形成血睾屏障,从而维持精子发育和成熟所需的环境
- 分泌减数分裂诱发物(meiosis-inducing substance,MIS)
- 分泌睾丸液
- 分泌性激素结合蛋白(ABP),富集睾酮从而促进配子发育
- 生殖道需要高浓度的睾酮建立稳态,性激素结合蛋白有利于生育力的维持。
- 分泌以抑制素(inhibin)等肽类激素为代表的激素,参与下丘脑-垂体-性腺轴对精子发生的调控
- 通过胞吞作用清理精子形成中的胞浆残余体
- 分泌抗米勒管激素(Anti-Müllerian hormone,AMH)使副中肾管退化,引起胚胎性别分化[16]
- 通过血睾屏障形成精子发育所需的免疫豁免环境
- 参与调节精原细胞的更新和维持
细胞间黏附因子 ICAM-1 和可溶性 ICAM-1对形成血睾屏障的紧密连接具有抑制作用[17]。ICAM-2 与精细胞在支持细胞顶部(朝向管腔一侧)的附着有关[17]。
影响因素[编辑]
精子发生对环境的波动极为敏感,尤其是激素和温度的变化。睾酮主要由生精小管外围的睾丸间质细胞分泌,生精小管中的性激素结合蛋白可以富集睾酮,使局部的睾酮浓度满足维持精子发生的需要。
人类和一些动物的生精上皮对温度升高较为敏感,即便是正常体温也会对精子发生造成不良影响。此外,大多数哺乳动物精母细胞中的 DNA 聚合酶 β 和重组酶需要特殊的最适温度,使得精子无法在核心体温下成熟[18]。因此哺乳动物的睾丸通常位于体外的囊状皮肤结构中,即阴囊。提睾肌和阴囊肉膜通过调控阴囊的血流量和位置,保持睾丸处于精子发生的最适温度下。人类精子发生的最适温度相较于体温要低 2°C,小鼠则要低 8°C。
睾丸的动脉血和静脉血的热交换是维持睾丸温度稳定的重要机制之一。睾丸的动脉和静脉在解剖上相互缠绕
激素调控[编辑]
精子发生的激素控制随物种而不同。人类精子发生的激素控制机制尚未被完全理解。
生精紊乱[编辑]
精子发生的紊乱可能导致少精症,即精液中的精子浓度偏低。少精症是男性不育的常见表现之一。
参考文献[编辑]
- ^ de Kretser, D. M.; Loveland, K. L.; Meinhardt, A.; Simorangkir, D.; Wreford, N. Spermatogenesis. Human Reproduction (Oxford, England). 1998-04,. 13 Suppl 1. ISSN 0268-1161. PMID 9663765. doi:10.1093/humrep/13.suppl_1.1.
- ^ 2.0 2.1 Sharma, Sachin; Hanukoglu, Aaron; Hanukoglu, Israel. Localization of epithelial sodium channel (ENaC) and CFTR in the germinal epithelium of the testis, Sertoli cells, and spermatozoa. Journal of Molecular Histology. 2018-04, 49 (2). ISSN 1567-2387. PMID 29453757. doi:10.1007/s10735-018-9759-2.
- ^ The Spermatozoön - Human Anatomy. www.theodora.com. [2024-06-10].
- ^ Song, Ning; Liu, Jie; An, Shucai; Nishino, Tomoya; Hishikawa, Yoshitaka; Koji, Takehiko. Immunohistochemical Analysis of Histone H3 Modifications in Germ Cells during Mouse Spermatogenesis. Acta Histochemica Et Cytochemica. 2011-08-27, 44 (4). ISSN 1347-5800. PMC 3168764
 . PMID 21927517. doi:10.1267/ahc.11027.
. PMID 21927517. doi:10.1267/ahc.11027.
- ^ Schulze, W. Evidence of a wave of spermatogenesis in human testis. Andrologia. 1982, 14 (2). ISSN 0303-4569. PMID 7103139. doi:10.1111/j.1439-0272.1982.tb03124.x.
- ^ Scrotum | Testes, Temperature & Protection | Britannica. www.britannica.com. 2024-06-01 [2024-06-10] (英语).
- ^ Spermatogenesis. Wikipedia. 2024-05-17 (英语).
- ^ Heller, C. H.; Clermont, Y. KINETICS OF THE GERMINAL EPITHELIUM IN MAN. Recent Progress in Hormone Research. 1964, 20. ISSN 0079-9963. PMID 14285045.
- ^ Spermatogenesis. Wikipedia. 2024-05-17 (英语).
- ^ Forster, Peter; Hohoff, Carsten; Dunkelmann, Bettina; Schürenkamp, Marianne; Pfeiffer, Heidi; Neuhuber, Franz; Brinkmann, Bernd. Elevated germline mutation rate in teenage fathers. Proceedings. Biological Sciences. 2015-03-22, 282 (1803). ISSN 1471-2954. PMC 4345458
 . PMID 25694621. doi:10.1098/rspb.2014.2898.
. PMID 25694621. doi:10.1098/rspb.2014.2898.
- ^ Book sources - Wikipedia. en.wikipedia.org. [2024-06-11] (英语).
- ^ Johnson, L.; Petty, C. S.; Neaves, W. B. Further quantification of human spermatogenesis: germ cell loss during postprophase of meiosis and its relationship to daily sperm production. Biology of Reproduction. 1983-08, 29 (1). ISSN 0006-3363. PMID 6615966. doi:10.1095/biolreprod29.1.207.
- ^ Alpatov, Roman; Lesch, Bluma J.; Nakamoto-Kinoshita, Mika; Blanco, Andres; Chen, Shuzhen; Stützer, Alexandra; Armache, Karim J.; Simon, Matthew D.; Xu, Chao; Ali, Muzaffar; Murn, Jernej. A chromatin-dependent role of the fragile X mental retardation protein FMRP in the DNA damage response. Cell. 2014-05-08, 157 (4). ISSN 1097-4172. PMC 4038154
 . PMID 24813610. doi:10.1016/j.cell.2014.03.040.
. PMID 24813610. doi:10.1016/j.cell.2014.03.040.
- ^ Fishelson, Lev; Gon, Ofer; Holdengreber, Vered; Delarea, Yakob. Comparative spermatogenesis, spermatocytogenesis, and spermatozeugmata formation in males of viviparous species of clinid fishes (Teleostei: Clinidae, Blennioidei). Anatomical Record (Hoboken, N.J.: 2007). 2007-03, 290 (3). ISSN 1932-8486. PMID 17525946. doi:10.1002/ar.20412.
- ^ Avidor-Reiss, Tomer; Khire, Atul; Fishman, Emily L.; Jo, Kyoung H. Atypical centrioles during sexual reproduction. Frontiers in Cell and Developmental Biology. 2015-04-01, 3. ISSN 2296-634X. doi:10.3389/fcell.2015.00021 (English).
- ^ Book sources - Wikipedia. en.wikipedia.org. [2024-06-11] (英语).
- ^ 17.0 17.1 Xiao, Xiang; Mruk, Dolores D.; Cheng, C. Yan. Intercellular adhesion molecules (ICAMs) and spermatogenesis. Human Reproduction Update. 2013, 19 (2). ISSN 1460-2369. PMC 3576004
 . PMID 23287428. doi:10.1093/humupd/dms049.
. PMID 23287428. doi:10.1093/humupd/dms049.
- ^ www.uwyo.edu https://www.uwyo.edu/wjm/repro/spermat.htm. [2024-06-11]. 缺少或
|title=为空 (帮助)
- The testes and spermatogenesis. University of Wisconsin. 1998 [2006-11-27]. (原始内容存档于2008-06-19).
- Johnson, L; Blanchard, TL; Varner, DD; Scrutchfield, WL. Factors affecting spermatogenesis in the stallion. Theriogenology. 1997, 48 (7): 1199–1216 [2013-11-09]. PMID 16728209. doi:10.1016/S0093-691X(97)00353-1. (原始内容存档于2013-11-09).
- BARDIN CW: Pituitary-testicular axis. In: YEN SS , JAFFEE RB , eds: Reproductive Endocrinology, 3rd ed. Philadelphia: WB Saunders, 1991
- CHAMBERS CV , SHAFER MA , ADGER H , et al.: Microflora of the urethra in adolescent boys: relationships to sexual activity and nongonococcal urethritis. J Ped 110:314-321, 1987
- CZYBA JC , GIROD C: Development of normal testis. In: HAFEZ ESE , ed: Descended and Cryptorchid Testis. The Hague, Martinus Nijhoff, 1980.
- Whitmore WF, Kars L, Gittes RF: The role of germinal epithelium and spermatogenesis in the privileged survival of intratesticular grafts. J Urol 1985;134:782.
外部链接[编辑]
- Spermatogenesis - male reproductive physiology (页面存档备份,存于互联网档案馆) - Am Fam Physician 2000;62:1095.
- Spermatogenesis animation (页面存档备份,存于互联网档案馆)
参见[编辑]
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||
