精子發生

精子發生(英語:spermatogenesis)是指有性生殖的雄性動物的生殖細胞在睪丸中的生精小管中發育為單倍體精子的過程。這一過程始於附著在生精小管基底膜的生殖細胞的有絲分裂[1]。這些生殖細胞被稱為精原細胞。精原細胞分為增加生殖細胞數量的 A 型精原細胞和將要分化為初級精母細胞的 B 型精原細胞。人類的精原細胞(A0)經歷七次有絲分裂(A1-A4、中間型、B 型)分化為初級精母細胞。初級精母細胞減數分裂(第一次減數分裂)為兩個次級精母細胞,次級精原細胞分別減數分裂(第二次減數分裂)為兩個相同的單倍體精子細胞(spermatid),之後進一步成熟為精子[2]。精子細胞分化、變態、成熟的過程稱為精子形成(spermiogenesis)。一個 B 型精原細胞通過上述過程產生四個單倍體的精子[3]。
精子發生是有性生殖的重要環節,適當的環境條件是精子發生正常進行的關鍵。DNA 甲基化和組蛋白修飾在精子生成過程中發揮調控作用[4]。精子發生開始於青春期,之後一般終身持續進行,但隨著年齡增長,產生的精子數量可能會有小幅降低(參見男性不育)。
精子發生起始於生精小管基底膜,細胞分裂、分化、成熟的同時沿生精小管移動並逐漸向內部遷移,最終向管腔釋放成熟的精子。精子發生過程中的分裂具有同步性,使生精小管的橫斷面呈現出不同發育階段對應的特定時相。生精小管上不同發育階段的細胞形成的一段橫切面的連續時相變化被稱為生精上皮周期[5]。
意義[編輯]
精子發生過程產生成熟的雄性配子,即精子。在有性生殖過程中,精子與雌性配子(卵細胞)結合使其受精。受精過程中,兩個單倍體的配子分別提供正常個體一半數量的染色體,重新組合成二倍體的受精卵。染色體數目改變通常會造成嚴重的胚胎發育障礙,為了保持後代染色體數量的穩定,配子的染色體數量必須減半。精子發生中的染色體數目異常可以引起人類的胚胎自然流產、先天性發育缺陷和認知障礙疾病(如唐氏症候群、克氏症候群)。

場所[編輯]
精子發生的起始階段發生在睪丸中,之後逐漸轉移至附睪,發育中的配子細胞在附睪中成熟,並儲存直到射精排出。睪丸中的生精小管是精子發生的起點,生精小管內壁上的精原細胞朝著中心分裂——從內壁逐漸遷移至管腔——來產生未成熟的精子[2],之後依次流入直精小管、睪丸網,最終通過 15-20 個輸出小管進入附睪中成熟。精子生成通常需要在低於體溫 1-8°C 的較低溫度下才能產生具有活性的精子,因此精子發生的場所(睪丸/陰囊)所處的溫度調節十分重要[6]。不過,臨床上發現小幅的溫度波動(如使用運動護襠帶來的溫度變化)對精子的活力和數量沒有負面影響[7]。
值得注意的是,精子發生並不能產生具有授孕能力的精子。精子最後的成熟階段,即獲能,發生在雌性的子宮或輸卵管內。在最後的獲能階段,精子失去頂體表面的糖蛋白和精液蛋白,使其得以發生頂體反應從而與卵子融合。[8]
周期[編輯]
根據不同的測定方法,人類精子發生周期的時間估算從 74 天(以氚標記活檢測定)[9][10]到 120 天(以表觀遺傳時鐘測定)[11]不等。精原細胞有絲分裂增殖大約需要 16 天;第一次減數分裂約需要 24 天,第二次減數分裂則僅需要數個小時;精細胞變態形成精子還需要約 24 天。如果計入精子在生精小管中轉運所需的時間,精子的形成大約需要三個月。男性的(一對)睪丸每天能產生 200 ~ 300 百萬個精細胞[12],但其中只有約一半(即 100 百萬)可以形成具有活力的精子[13]。
階段[編輯]
人類精子發生的過程可以根據細胞類型劃分為數個階段。下表中除初級精母細胞中「倍性/ DNA 拷貝數/染色體數量」是 DNA 複製後、細胞分裂前的計數外,其他細胞的計數是指在 DNA 複製和細胞分裂之前的計數(即 G1 期)。
| 細胞類型 | 倍性/染色體數量(人類) | DNA拷貝數/染色單體數量(人類) | 進入下一階段所經歷的過程 |
| 精原細胞 (Ad 型、Ap 型和 B 型) | 二倍體 (2N) / 46 | 2C / 46 | 精母細胞發生(有絲分裂) |
| 初級精母細胞 | 二倍體 (2N) / 46 | 4C / 46 | 精細胞發生(第一次減數分裂) |
| 2個次級精母細胞 | 單倍體 (N) / 23 | 2C / 46 | 精細胞發生(第二次減數分裂) |
| 4個精細胞 | 單倍體 (N) / 23 | 1C / 23 | 精子形成 |
| 4個精子 | 單倍體 (N) / 23 | 1C / 23 | 精子釋放 |
精母細胞發生[編輯]
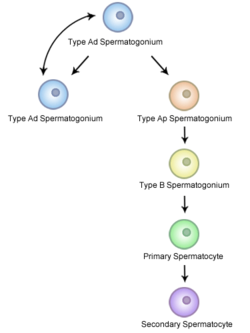
雄性配子發生的過程被稱為精母細胞發生。在這一過程中,位於生精小管的基底室(basal compartment)的精原細胞發生有絲分裂,形成兩個二倍體的中間體,稱為初級精母細胞。根據精原細胞的核形態的不同可以將其分為 A 型精原細胞和 B 型精原細胞。A 型精原細胞的異染色質較少,分化程度較低;B 型精原細胞異染色質比例較高,說明其轉錄活動較低,分化程度較高。A 型精原細胞可以根據其細胞形態進一步分為 Ad(dark)精原細胞和 Ap(pale)精原細胞:Ad細胞位於生精小管基底膜上,分裂活動較低,一般認為是幹細胞和儲備精原細胞,是其他 Ad 精原細胞和 Ap 精原細胞的祖細胞;Ap 精原細胞不斷分裂並逐漸向生精小管的管腔方向遷移,最終產生 B 型精原細胞。B 型精原細胞是形成精母細胞的祖細胞。在人類中,A 型精原細胞(A0)一般經過六輪分裂(A1-A4、中間型)形成 B 型精原細胞。
初級精母細胞遷移至生精小管的近腔室(adluminal compartment)進行 DNA 複製,然後發生第一次減數分裂,產生兩個單倍體的次級精母細胞,接著發生第二次減數分裂產生單倍體的精細胞。第一次減數分裂的前期長達 22-24 天,因此成為組織切片中比例最多的細胞。根據初級精母細胞的細胞核的染色特徵,可以將前期分為五個階段:
- 細線期(凝集期):此時 DNA 已開始複製,染色質初步螺旋化形成線狀,為偶線期做準備。
- 偶線期(合線期):染色質進一步螺旋化,偶線期 DNA 完成複製,同源染色體發生聯會。
- 粗線期(重組期):同源染色體緊貼合併(假減數),發生同源染色體重組,可以看到清晰的核仁
- 雙線期:同源染色體分離形成四分體,不完全分開的部分稱為交叉,染色體上大量的轉錄泡形成典型的燈刷染色體結構
- 縮線期(終變期):同源染色體最終完全脫離,核膜、核仁消失,準備形成紡錘體進行減數分裂
精母細胞發生的過程通過染色體聯會和同源染色體重組增加配子的遺傳多樣性。DNA 損傷應答(DDR)是精母細胞發生中的重要機制。DNA 損傷修復的關鍵蛋白 FMRP 在精母細胞發生的減數分裂過程中結合在染色體上調控 DNA 損傷應答[14]。
精母細胞發生中細胞進行不完全分裂,子代細胞通過細胞質間橋相連,使細胞發育的狀態同步化。精原細胞不斷通過有絲分裂補充自身的數量,為精母細胞發生提供持續的精原細胞供應,確保不斷進行的精母細胞發生不會耗盡睪丸中的精原細胞[15]。
精細胞發生[編輯]
精細胞生成是次級精母細胞產生精細胞的過程。精母細胞發生中產生的次級精母細胞迅速進入第二次減數分裂產生單倍體的圓形精細胞。這一階段十分短暫,因此在組織切片中很難觀察到次級精母細胞。
精子形成[編輯]
在精子形成階段中,精細胞的一個中心粒上的微管延伸形成尾部,延伸出的微管形成軸絲,相應的中心粒形成毛基體,從而使中心體減半[16]。精細胞延伸的同時,DNA 首先與特定的鹼性核蛋白結合,之後逐步替換為與精蛋白緊密結合,包裝為高度濃縮、失去轉錄活性的染色質。包裹濃縮細胞核的高爾基體在中心粒遷移方向相反的一極積累頂體顆粒。這一階段被稱為高爾基期。
隨著囊泡和頂體顆粒的擴張,頂體顆粒融合形成包裹細胞核前半部分的頂體。粒線體圍繞軸絲的前端(中段)排列使其變粗,為精子尾部擺動供能。同時,精子的細胞核逐漸伸長,朝向發生定向的改變(頭部朝向生精小管的管壁,尾部朝管腔延伸)。這一階段被稱為頂體期。
最終在睪酮的誘導下,精細胞進一步成熟,除去殘餘的胞漿和細胞器。排出的胞漿稱為殘餘體,將由周圍的支持細胞通過胞吞作用吸收。這一階段稱為成熟期。此階段的成熟精細胞還不具有運動能力。成熟的精細胞從支持細胞上釋放到生精小管的管腔中的過程稱為精子釋放。精細胞變形為精子的過程需要 12-24 天。
在生精小管的蠕動幫助下,不具運動能力的成熟精細胞隨支持細胞分泌的睪丸液轉運至附睪中。成熟精細胞在附睪中成為具有游動能力的精子。但精子並不依靠自身的游動通過男性生殖系統的剩餘部分,而是藉由肌肉收縮被排出體外。
支持細胞的作用[編輯]
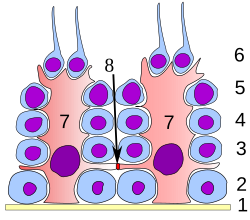
塞爾托利氏細胞又稱支持細胞。支持細胞為精子發生過程提供結構性和營養的支持作用。在精子發生的各個階段,生精細胞都與支持細胞保持緊密接觸。每一個支持細胞的都從生精小管的基底膜延伸至管腔,但這一結構在光鏡下通常難以分辨。
支持細胞在精子發生過程中發揮多種功能,它們以下列方式支持配子的發育:
- 形成血睪屏障,從而維持精子發育和成熟所需的環境
- 分泌減數分裂誘發物(meiosis-inducing substance,MIS)
- 分泌睪丸液
- 分泌以抑制素(inhibin)等肽類激素為代表的激素,參與下視丘-垂體-性腺軸對精子發生的調控
- 通過胞吞作用清理精子形成中的胞漿殘餘體
- 分泌抗米勒管激素(Anti-Müllerian hormone,AMH)使副中腎管退化,引起胚胎性別分化[17]
- 通過血睪屏障形成精子發育所需的免疫豁免環境
- 參與調節精原細胞的更新和維持
支持細胞在青春期後不再進行細胞分裂,從而與相鄰的生殖細胞保持穩定的位置關係[18]。雖然支持細胞無法增殖,但其抗逆能力(如 X 射線、營養不良和感染)非常高,因此不易因環境因素受損[19]。
細胞間黏附因子 ICAM-1 和可溶性 ICAM-1對形成血睪屏障的緊密連接具有抑制作用[20]。ICAM-2 與精細胞在支持細胞頂部(朝向管腔一側)的附著有關[20]。
影響因素[編輯]
精子發生對環境的波動極為敏感,尤其是激素和溫度的變化。睪酮主要由生精小管外圍的睪丸間質細胞分泌,生精小管中的性激素結合蛋白可以富集睪酮,使局部的睪酮濃度滿足維持精子發生的需要。
人類和一些動物的生精上皮對溫度升高較為敏感,即便是正常體溫也會對精子發生造成不良影響。此外,大多數哺乳動物精母細胞中的 DNA 聚合酶 β 和重組酶需要特殊的最適溫度,使得精子無法在核心體溫下成熟[21]。因此哺乳動物的睪丸通常位於體外的囊狀皮膚結構中,即陰囊。提睪肌和陰囊肉膜通過調控陰囊的血流量[22]和位置,保持睪丸處於精子發生的最適溫度下。人類精子發生的最適溫度相較於體溫要低 2°C,小鼠則要低 8°C。
睪丸的動脈血和靜脈血的熱交換是維持睪丸溫度穩定的重要機制之一。睪丸靜脈在兩個區域盤繞精索內動脈,這種特殊的解剖結構增加了流入睪丸的動脈血與回流的靜脈血之間的接觸時間和熱交換程度,一定程度上解釋了犬和羊中觀察到的主動脈和睪丸動脈血之間的溫度差異。此外,精索內動脈的前1/3段呈現脈壓差的降低[23][24]。此外,精母細胞中重組酶水平的降低可能是睪丸退行性改變的重要因素[25]。
營養不良(如缺乏維生素 E)、合成類固醇、重金屬(如鎘和鉛)、X 射線、二噁英、酒精以及感染性疾病都可能對精子發生的速率產生不利影響[26]。此外,氧化應激易對生殖細胞造成 DNA 損傷,這些損傷可能顯著影響男性的生育力[27]。也有報導發現殺蟲劑的暴露水平會影響精子發生[28]。
激素調控[編輯]
精子發生的激素控制隨物種而不同。人類精子發生的激素控制機制尚未完全揭示,但已知男性青春期的下視丘-垂體-性腺軸的活動啟動了精子發生。垂體受損時,促卵泡激素(FSH)和睪酮也可以直接啟動精子生成[29]。黃體生成素(LH)可以促進生殖腺的睪酮分泌,但對精子生成似乎沒有直接的作用[29][30]。
FSH 刺激支持細胞形成血睪屏障和產生性激素結合蛋白(ABP)。性激素結合蛋白是維持生精過程需要的局部高睪酮水平的關鍵。睪丸中的睪酮水平約為外周血中的 20-100 或 50-200 倍,不過健康男性之間的睪酮水平可能存在 5 到 10 倍的差距[31][32]。睪酮水平呈現節律性的周期變化,一般在晨起時達到峰值,這也解釋了男性的晨勃現象。青年男性的睪酮水平更高。FSH 可能啟動了睪丸的睪酮生成和精子發生,但在啟動後只需要睪酮即可維持精子發生的進行[29]。不過 FSH 水平的升高可以通過減少 A 型精原細胞的凋亡來增加精細胞的生成數量。抑制素(inhibin)通過降低 FSH 的水平來發揮功能。齧齒類動物中的研究發現促性腺激素(FSH 和 LH)可以通過抑制精母細胞的促凋亡信號轉導來促進精子發生[33]。
支持細胞本身也通過分泌激素參與精子生成的調控。支持細胞可以產生雌二醇和抑制素。睪丸間質細胞除了產生睪酮外,也可以產生相對較少的雌二醇。在動物模型中發現雌激素對於精子發生而言是必要的[34][35],然而雌激素不敏感症候群(α 雌激素受體缺陷)的男性患者表現為正常的精子計數,但精子成活率較低,患者的生育力不明[36]。過高的雌激素水平可能導致睪丸中過量睪酮分泌和促性腺激素分泌的抑制[37],從而損害精子發生。催乳素與精子發生也有一定的相關性,正常範圍的催乳素水平可以側面反映有效精子生成的進行[30][38]。
與卵細胞發生的對比[編輯]
與女性產生卵細胞的過程相比,精原細胞形成具有游動能力的精子的過程中失去了絕大部分的細胞質和其中包含的細胞器,這些組分均在卵細胞中得以保留。一個初級精母細胞會產生四個精子,而對應的初級卵母細胞最終僅產生一個卵細胞。在人類中,女性的卵原細胞在胎兒卵巢中即轉化為初級卵母細胞,在青春期前停留在第一次減數分裂的晚期(雙線期),出生後卵母細胞的數量不斷減少;而男性的精原細胞則要到青春期才啟動精母細胞的生成,精子發生中的減數分裂和分化持續進行,並且可以維持終身。精子發生過程中由於性染色體無法配對,因此不會發生性染色體的重組和轉錄。男性的精子發生也不具有女性卵細胞發生的激素調節周期那樣明顯的周期性。
生精障礙[編輯]
精子發生的障礙可能導致少精症,即精液中的精子濃度偏低[39]。少精症是男性不育的常見表現之一。
可能導致生精障礙的常見原因之一是隱睪,即睪丸不完全下降至陰囊中的情況。通常在胎兒時期睪丸即下降到陰囊中,如果在出生後三個月以上睪丸仍未降至陰囊中,則睪丸所處的溫度(37°C)可能會阻礙精子的正常產生。這一類男性不育症可以通過外科手術治療改善。
其他影響精子發生的因素包括電離輻射、藥物、酗酒、重金屬、精神壓力核營養不良。此外,纖毛相關的疾病(如原發性纖毛運動不良症)除了影響呼吸系統外還會影響正常精子的形成,主要表現為精子缺乏活動能力。
參考文獻[編輯]
- ^ de Kretser, D. M.; Loveland, K. L.; Meinhardt, A.; Simorangkir, D.; Wreford, N. Spermatogenesis. Human Reproduction (Oxford, England). 1998-04,. 13 Suppl 1. ISSN 0268-1161. PMID 9663765. doi:10.1093/humrep/13.suppl_1.1.
- ^ 2.0 2.1 Sharma, Sachin; Hanukoglu, Aaron; Hanukoglu, Israel. Localization of epithelial sodium channel (ENaC) and CFTR in the germinal epithelium of the testis, Sertoli cells, and spermatozoa. Journal of Molecular Histology. 2018-04, 49 (2). ISSN 1567-2387. PMID 29453757. doi:10.1007/s10735-018-9759-2.
- ^ The Spermatozoön - Human Anatomy. www.theodora.com. [2024-06-10].
- ^ Song, Ning; Liu, Jie; An, Shucai; Nishino, Tomoya; Hishikawa, Yoshitaka; Koji, Takehiko. Immunohistochemical Analysis of Histone H3 Modifications in Germ Cells during Mouse Spermatogenesis. Acta Histochemica Et Cytochemica. 2011-08-27, 44 (4). ISSN 1347-5800. PMC 3168764
 . PMID 21927517. doi:10.1267/ahc.11027.
. PMID 21927517. doi:10.1267/ahc.11027.
- ^ Schulze, W. Evidence of a wave of spermatogenesis in human testis. Andrologia. 1982, 14 (2). ISSN 0303-4569. PMID 7103139. doi:10.1111/j.1439-0272.1982.tb03124.x.
- ^ Scrotum | Testes, Temperature & Protection | Britannica. www.britannica.com. 2024-06-01 [2024-06-10] (英語).
- ^ Spermatogenesis. Wikipedia. 2024-05-17 (英語).
- ^ Johnson, M. H.; Everitt, Barry J. Essential reproduction. 6th ed. Malden, Mass: Blackwell Pub https://zh.wikipedia.org/wiki/Special:%E7%BD%91%E7%BB%9C%E4%B9%A6%E6%BA%90/978-1-4051-1866-8. 2007. ISBN 978-1-4051-1866-8. OCLC 76074156. 缺少或
|title=為空 (幫助) - ^ Heller, C. H.; Clermont, Y. KINETICS OF THE GERMINAL EPITHELIUM IN MAN. Recent Progress in Hormone Research. 1964, 20. ISSN 0079-9963. PMID 14285045.
- ^ Spermatogenesis. Wikipedia. 2024-05-17 (英語).
- ^ Forster, Peter; Hohoff, Carsten; Dunkelmann, Bettina; Schürenkamp, Marianne; Pfeiffer, Heidi; Neuhuber, Franz; Brinkmann, Bernd. Elevated germline mutation rate in teenage fathers. Proceedings. Biological Sciences. 2015-03-22, 282 (1803). ISSN 1471-2954. PMC 4345458
 . PMID 25694621. doi:10.1098/rspb.2014.2898.
. PMID 25694621. doi:10.1098/rspb.2014.2898.
- ^ Book sources - Wikipedia. en.wikipedia.org. [2024-06-11] (英語).
- ^ Johnson, L.; Petty, C. S.; Neaves, W. B. Further quantification of human spermatogenesis: germ cell loss during postprophase of meiosis and its relationship to daily sperm production. Biology of Reproduction. 1983-08, 29 (1). ISSN 0006-3363. PMID 6615966. doi:10.1095/biolreprod29.1.207.
- ^ Alpatov, Roman; Lesch, Bluma J.; Nakamoto-Kinoshita, Mika; Blanco, Andres; Chen, Shuzhen; Stützer, Alexandra; Armache, Karim J.; Simon, Matthew D.; Xu, Chao; Ali, Muzaffar; Murn, Jernej. A chromatin-dependent role of the fragile X mental retardation protein FMRP in the DNA damage response. Cell. 2014-05-08, 157 (4). ISSN 1097-4172. PMC 4038154
 . PMID 24813610. doi:10.1016/j.cell.2014.03.040.
. PMID 24813610. doi:10.1016/j.cell.2014.03.040.
- ^ Fishelson, Lev; Gon, Ofer; Holdengreber, Vered; Delarea, Yakob. Comparative spermatogenesis, spermatocytogenesis, and spermatozeugmata formation in males of viviparous species of clinid fishes (Teleostei: Clinidae, Blennioidei). Anatomical Record (Hoboken, N.J.: 2007). 2007-03, 290 (3). ISSN 1932-8486. PMID 17525946. doi:10.1002/ar.20412.
- ^ Avidor-Reiss, Tomer; Khire, Atul; Fishman, Emily L.; Jo, Kyoung H. Atypical centrioles during sexual reproduction. Frontiers in Cell and Developmental Biology. 2015-04-01, 3. ISSN 2296-634X. doi:10.3389/fcell.2015.00021 (English).
- ^ Book sources - Wikipedia. en.wikipedia.org. [2024-06-11] (英語).
- ^ Fonti librarie - Wikipedia. it.wikipedia.org. [2024-06-12] (義大利語).
- ^ Fonti librarie - Wikipedia. it.wikipedia.org. [2024-06-12] (義大利語).
- ^ 20.0 20.1 Xiao, Xiang; Mruk, Dolores D.; Cheng, C. Yan. Intercellular adhesion molecules (ICAMs) and spermatogenesis. Human Reproduction Update. 2013, 19 (2). ISSN 1460-2369. PMC 3576004
 . PMID 23287428. doi:10.1093/humupd/dms049.
. PMID 23287428. doi:10.1093/humupd/dms049.
- ^ www.uwyo.edu https://www.uwyo.edu/wjm/repro/spermat.htm. [2024-06-11]. 缺少或
|title=為空 (幫助) - ^ Harrison, R. G.; Weiner, J. S. Vascular patterns of the mammalian testis and their functional significance. The Journal of Experimental Biology. 1949-10, 26 (3). ISSN 0022-0949. PMID 15407652. doi:10.1242/jeb.26.3.304.
- ^ Kandeel, F. R.; Swerdloff, R. S. Role of temperature in regulation of spermatogenesis and the use of heating as a method for contraception. Fertility and Sterility. 1988-01, 49 (1). ISSN 0015-0282. PMID 3275550. doi:10.1016/s0015-0282(16)59640-x.
- ^ https://pubmed.ncbi.nlm.nih.gov/7401033. 缺少或
|title=為空 (幫助) - ^ Hotta, Y.; Fujisawa, M.; Tabata, S.; Stern, H.; Yoshida, S. The effect of temperature on recombination activity in testes of rodents. Experimental Cell Research. 1988-09, 178 (1). ISSN 0014-4827. PMID 2900772. doi:10.1016/0014-4827(88)90387-4.
- ^ Jenardhanan, Pranitha; Panneerselvam, Manivel; Mathur, Premendu P. Effect of environmental contaminants on spermatogenesis. Seminars in Cell & Developmental Biology. 2016-11, 59. ISSN 1096-3634. PMID 27060550. doi:10.1016/j.semcdb.2016.03.024.
- ^ www.semanticscholar.org https://www.semanticscholar.org/paper/092715dfa1ebc3bab5ef9545d3bb9c36d4de96ab. [2024-06-12]. 缺少或
|title=為空 (幫助) - ^ www.semanticscholar.org https://www.semanticscholar.org/paper/5f90e4abc7687d6777a39088c4872c5ccf8cc758. [2024-06-12]. 缺少或
|title=為空 (幫助) - ^ 29.0 29.1 29.2 Book sources - Wikipedia. en.wikipedia.org. [2024-06-12] (英語).
- ^ 30.0 30.1 Fody, E. P.; Walker, E. M. Effects of drugs on the male and female reproductive systems. Annals of Clinical and Laboratory Science. 1985, 15 (6). ISSN 0091-7370. PMID 4062226.
- ^ Schill, Wolf-Bernhard; Comhaire, F. H.; Hargreave, Timothy Bruce. Andrology for the clinician. Berlin New York: Springer https://en.wikipedia.org/wiki/Special:BookSources/978-3-540-33713-3. 2006. ISBN 978-3-540-33713-3. 缺少或
|title=為空 (幫助) - ^ Nieschlag, E. (編). Testosterone: action, deficiency, substitution. 4th ed. Cambridge: Cambridge University Press https://en.wikipedia.org/wiki/Special:BookSources/978-1-107-01290-5. 2012. ISBN 978-1-107-01290-5. 缺少或
|title=為空 (幫助) - ^ Pareek, Tej K.; Joshi, Ayesha R.; Sanyal, Amartya; Dighe, Rajan R. Insights into male germ cell apoptosis due to depletion of gonadotropins caused by GnRH antagonists. Apoptosis: An International Journal on Programmed Cell Death. 2007-06, 12 (6). ISSN 1360-8185. PMID 17268770. doi:10.1007/s10495-006-0039-3.
- ^ O'Donnell, L.; Robertson, K. M.; Jones, M. E.; Simpson, E. R. Estrogen and spermatogenesis. Endocrine Reviews. 2001-06, 22 (3). ISSN 0163-769X. PMID 11399746. doi:10.1210/edrv.22.3.0431.
- ^ Carreau, Serge; Bouraima-Lelong, Helene; Delalande, Christelle. Role of estrogens in spermatogenesis. Frontiers in Bioscience (Elite Edition). 2012-01-01, 4 (1). ISSN 1945-0508. PMID 22201851. doi:10.2741/e356.
- ^ Smith, E. P.; Boyd, J.; Frank, G. R.; Takahashi, H.; Cohen, R. M.; Specker, B.; Williams, T. C.; Lubahn, D. B.; Korach, K. S. Estrogen resistance caused by a mutation in the estrogen-receptor gene in a man. The New England Journal of Medicine. 1994-10-20, 331 (16). ISSN 0028-4793. PMID 8090165. doi:10.1056/NEJM199410203311604.
- ^ Sabanegh, Edmund S. Male infertility: problems and solutions. Current clinical urology. New York: Humana Press https://en.wikipedia.org/wiki/Special:BookSources/978-1-60761-193-6. 2011. ISBN 978-1-60761-193-6. 缺少或
|title=為空 (幫助) - ^ Spaggiari, Giorgia; Costantino, Francesco; Granata, Antonio R. M.; Tagliavini, Simonetta; Canu, Giulia; Varani, Manuela; De Santis, Maria Cristina; Roli, Laura; Trenti, Tommaso; Simoni, Manuela; Santi, Daniele. Prolactin and spermatogenesis: new lights on the interplay between prolactin and sperm parameters. Endocrine. 2023-08, 81 (2). ISSN 1559-0100. PMID 37140814. doi:10.1007/s12020-023-03375-x.
- ^ Spermatogenesis. Wikipedia. 2024-06-11 (英語).
- The testes and spermatogenesis. University of Wisconsin. 1998 [2006-11-27]. (原始內容存檔於2008-06-19).
- Johnson, L; Blanchard, TL; Varner, DD; Scrutchfield, WL. Factors affecting spermatogenesis in the stallion. Theriogenology. 1997, 48 (7): 1199–1216 [2013-11-09]. PMID 16728209. doi:10.1016/S0093-691X(97)00353-1. (原始內容存檔於2013-11-09).
- BARDIN CW: Pituitary-testicular axis. In: YEN SS , JAFFEE RB , eds: Reproductive Endocrinology, 3rd ed. Philadelphia: WB Saunders, 1991
- CHAMBERS CV , SHAFER MA , ADGER H , et al.: Microflora of the urethra in adolescent boys: relationships to sexual activity and nongonococcal urethritis. J Ped 110:314-321, 1987
- CZYBA JC , GIROD C: Development of normal testis. In: HAFEZ ESE , ed: Descended and Cryptorchid Testis. The Hague, Martinus Nijhoff, 1980.
- Whitmore WF, Kars L, Gittes RF: The role of germinal epithelium and spermatogenesis in the privileged survival of intratesticular grafts. J Urol 1985;134:782.
外部連結[編輯]
- Spermatogenesis - male reproductive physiology (頁面存檔備份,存於網際網路檔案館) - Am Fam Physician 2000;62:1095.
- Spermatogenesis animation (頁面存檔備份,存於網際網路檔案館)
參見[編輯]
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||
