克諾爾喹啉合成
外觀
(重新導向自Knorr喹啉合成)
| Knorr quinoline synthesis | |
|---|---|
| 命名根據 | Ludwig Knorr |
| 反應類型 | 成環反應 |
| 標識 | |
| RSC序號 | RXNO:0000394 |
克諾爾喹啉合成(Knorr quinoline synthesis),由德國化學家路德維希·克諾爾(Ludwig Knorr,1859-1921)1886年首先報道。[1]

此反應是親電芳香取代反應,總過程消除一分子水。
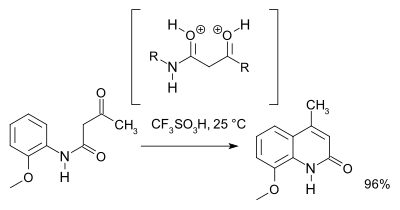
1964年Staskun研究發現在特定條件下4-羥基喹啉是反應的副產物。[2]例如,苯甲酰基乙酰苯胺(1)在遠過量的多聚磷酸催化下生成的產物是2-羥基喹啉(2),不過如果用少量的多聚磷酸催化,則會生成4-羥基喹啉(3)。Staskun提出如下N,O-雙正離子和 N-正離子中間體以解釋這兩個產物在不同酸性條件下的生成。

2007年克隆普等利用理論計算和核磁共振譜結果,提出超親電性的O,O-二正離子中間體在反應條件下比N,O-二正離子更容易生成。而且他們還發現質子酸性的三氟甲磺酸是此反應最有效的酸催化劑。[3]
參見
[編輯]參考資料
[編輯]- ^ Ludwig Knorr. Synthetische Versuche mit dem Acetessigester. Justus Liebig's Annalen der Chemie. 1886, 236 (1-2): 69–115. doi:10.1002/jlac.18862360105.
- ^ B. Staskun. The Conversion of Benzoylacetanilides into 2- and 4-Hydroxyquinolines. J. Org. Chem. 1964, 29 (5): 1153–1157. doi:10.1021/jo01028a038.
- ^ Kiran Kumar Solingapuram Sai, Thomas M. Gilbert, and Douglas A. Klumpp. Knorr Cyclizations and Distonic Superelectrophiles. J. Org. Chem. 2007, 72: 9761–9764. doi:10.1021/jo7013092.
