巴尔托利吲哚合成
外观
巴尔托利吲哚合成(Bartoli indole synthesis),又称巴尔托利反应,指从邻取代的芳香硝基化合物与乙烯基格氏试剂制备取代吲哚。[1][2][3][4]
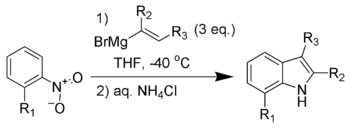
底物硝基邻位无取代基时,反应一般不能发生。通常用三倍量的格氏试剂,确保产率。
类似的反应还有Leimgruber-Batcho吲哚合成,但巴尔托利吲哚合成的优点在于这个反应可以在碳环和杂环上都引入取代基。
反应机理
[编辑]以邻硝基甲苯(1)与丙烯基格氏试剂(2)生成3,7-二甲基吲哚(13)的反应为例:[7]

首先格氏试剂与硝基芳烃加成为中间体(3)。(3)自发分解为亚硝基芳烃(4)和醇镁(5)。(5)在反应最后酸化时可以转化为羰基化合物(6)。(4)则与第二分子格氏试剂加成为中间体(7),邻位取代基的位阻引发(7)的[3,3]-σ迁移反应,使其转变为(8)。(8)发生分子内亲核加成,环合,再经芳构化得到(10)。(10)再与第三分子的格氏试剂作用,生成羟基二氢吲哚的镁盐(12)。最后酸化,(12)水解,消除一分子水,得到吲哚衍生物(13)。
可见,三分子格氏试剂的作用分别是:一分子在第二步被消除,最终转化为羰基化合物(6);一分子与氮上的氢发生交换,生成烯烃(11);一分子成为吲哚环的C-2和C-3。
反应中的亚硝基芳烃中间体(4)可以分离出来。它与两分子格氏试剂反应,也可得到吲哚,说明它是反应的中间体。
变体
[编辑]多布斯改进法
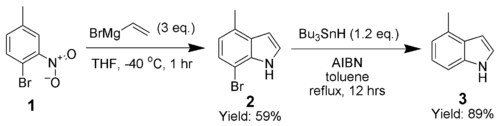
[编辑]阿德里安·多布斯用邻位的溴作定位基成环,反应后再用偶氮二异丁腈和三丁基锡烷将溴除去,生成7-位无取代基的吲哚。[8]
参见
[编辑]参考资料
[编辑]- ^ Bartoli, G.; Palmieri, G.; Bosco, M.; Dalpozzo, R. The reaction of vinyl grignard reagents with 2-substituted nitroarenes: A new approach to the synthesis of 7-substituted indoles. Tetrahedron Lett. 1989, 30: 2129–2132. doi:10.1016/S0040-4039(01)93730-X.)
- ^ Bartoli, G.; Bosco, M.; Dalpozzo, R.; Palmieri, G.; Marcantoni, E. Reactivity of nitro- and nitroso-arenes with vinyl grignard reagents: synthesis of 2-(trimethylsilyl)indoles. J. Chem. Soc., Perkin Trans. 1. 1991, 1: 2757–2761. doi:10.1039/p19910002757.
- ^ Dobbs, A. P.; Voyle, M.; Whitall, N. Synthesis of Novel Indole Derivatives: Variations in the Bartoli Reaction. Synlett. 1999, 1999: 1594–1596. doi:10.1055/s-1999-2900.
- ^ Dalpozzo, R.; Bartoli, G. Bartoli Indole Synthesis (PDF). Curr. Org. Chem. 2005, 9: 163–178 [2009-09-23]. doi:10.2174/1385272053369204. (原始内容 (PDF)存档于2007-09-28).
- ^ Dobson, D.; Todd, A.; Gilmore, J. The Synthesis of 7-Alkoxyindoles. Synth. Commun. 1991, 21: 611–617. doi:10.1080/00397919108020827.
- ^ Dobson, D. R.; Gilmore, J.; Long, D. A. Synthesis of 7-Formylindole Using the Bartoli Indole Methodology. Synlett. 1992, 1992: 79–80. doi:10.1055/s-1992-21273.
- ^ Bosco, M.; Dalpozzo, R.; Bartoli, G.; Palmieri, G.; Petrini, M. J. Chem. Soc. Perkin Trans. 2 1991, 657-663.
- ^ Dobbs, A. Total Synthesis of Indoles from Tricholoma Species via Bartoli/Heteroaryl Radical Methodologies. J. Org. Chem. 2001, 66: 638–641. doi:10.1021/jo0057396.
