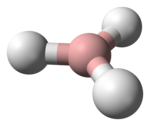
甲硼烷
| 甲硼烷 | |||
|---|---|---|---|

| |||
| |||
| IUPAC名 Borane trihydridoboron | |||
| 识别 | |||
| CAS号 | 13283-31-3 | ||
| PubChem | 6331 | ||
| ChemSpider | 6091 | ||
| SMILES |
| ||
| Gmelin | 44 | ||
| ChEBI | 30149 | ||
| 性质 | |||
| 化学式 | BH3 | ||
| 摩尔质量 | 13.83 g·mol⁻¹ | ||
| 结构 | |||
| 偶极矩 | 0 D | ||
| 危险性 | |||
| 自燃温度 | 38 °C | ||
| 相关物质 | |||
| 相关硼化合物 | 乙硼烷 三氟化硼 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
甲硼烷,又称三氢化硼,是一種无机化合物,化学式为BH3。它很不稳定,具有高反应性。羰基甲硼烷(BH3CO)的制备在探索甲硼烷的化学过程中起着重要作用,因为它可能存在甲硼烷分子。 [1] 但是,BH3分子是非常强的路易斯酸。因此,它具有很高的反应性,只能直接在流动系统中以连续产生的,短暂的产物形式观察到。甲硼烷也可以通过激光烧蚀的原子硼与氢的反应而直接观察到。 [2]
结构
BH3中,硼原子为sp2杂化,分子为平面三角形结构,D3h对称群,与价层电子对互斥理论的预测相吻合。尽管B-H键是极性共价键,但其分子对称性抵消了偶极矩,使得偶极矩为0。B–H键的键长为119 pm。[3]
在正常情况下,BH3会二聚成B2H6。甲硼烷是制备乙硼烷时的中间产物:[4]
- BX3 +BH4− → HBX3− + (BH3) (X=F, Cl, Br, I)
- 2 BH3 → B2H6
估计BH3的二聚标准焓为−170 kJ mol−1。[5] BH3 中的硼有 6 颗价电子。 因此,它是强路易斯酸,并与任何路易斯碱,也就是下方的L反应,形成加合物。
- BH3 + L → L—BH3
路易斯碱会把一对价电子捐给甲硼烷分子,形成一个共价配位键。 有一些化合物是热稳定的,不过容易被空气氧化。含有甲硫醚硼烷和四氢呋喃硼烷的溶液可商购获得,不过要在四氢呋喃硼烷中加入稳定剂,以防止THF氧化甲硼烷。 [6] 根据光谱和热化学数据估算的几种甲硼烷常见的加合物的稳定性序列如下:
BH3 是一种软酸,和硫原子加合所形成的化合物比和氧原子加合稳定。[4]BH3 的水溶液极度不稳定。[7][8]
- BH
3 + 3H
2O → B(OH)
3 + 3 H
2
反应
BH3是乙硼烷反应时的中间活性体,可以合成更大的硼烷:[4]
之后的过程会产生更大的硼烷,最终产物是 B10H14 作为受聚合物材料污染的最稳定物质,还有少量的 B20H26。
硼烷氨,可以由其它甲硼烷加合物的置换反应获得。加热时,硼烷氨中的氢气流失,形成环硼氮烷,化学式(HBNH)3。[9]
甲硼烷的加合物被广泛用于有机合成的硼氢化反应。在硼氢化反应中, BH3 被加入到烯烃的 C=C 双键并形成三烷基硼:
- (THF)BH3 + 3 CH2=CHR → B(CH2CH2R)3 + THF
该反应是区域选择性的,可以使用其他硼烷衍生物来提供更高的区域选择性。 [10] 产物三烷基硼可以转化为有用的有机衍生物。使用大体积烯烃可以制备诸如[HBR2]2的物质,它们在更专业的应用中也是有用的试剂。 比四氢呋喃硼烷稳定的甲硫醚硼烷也能被使用。[11][10]
硼氢化反应可以与氧化反应结合,形成硼氢化-氧化反应。在该反应中,生成的有机硼化合物中的硼烷基会被羟基取代。
甲硼烷(5)
甲硼烷(5)是甲硼烷的双氢配合物,化学式BH5 或 BH3(η2-H2).[12]它只能在低温下存在。[13][14] 甲硼烷(5)和甲𬭩离子 (CH5+) 是等电子体。[15]它是硼氢离子的共轭碱。
参见
参考资料
- ^ Burg, Anton B.; Schlesinger, H. I. Hydrides of boron. VII. Evidence of the transitory existence of borine (BH
3): Borine carbonyl and borine trimethylammine. Journal of the American Chemical Society. May 1937, 59 (5): 780–787. doi:10.1021/ja01284a002. - ^ Tague, Thomas J.; Andrews, Lester. Reactions of Pulsed-Laser Evaporated Boron Atoms with Hydrogen. Infrared Spectra of Boron Hydride Intermediate Species in Solid Argon. Journal of the American Chemical Society. 1994, 116 (11): 4970–4976. ISSN 0002-7863. doi:10.1021/ja00090a048.
- ^ Kawaguchi, Kentarou. Fourier transform infrared spectroscopy of the BH3 ν3 band. The Journal of Chemical Physics. 1992, 96 (5): 3411. Bibcode:1992JChPh..96.3411K. ISSN 0021-9606. doi:10.1063/1.461942.
- ^ 4.0 4.1 4.2 Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- ^ Page, M.; Adams, G.F.; Binkley, J.S.; Melius, C.F. Dimerization energy of borane. J. Phys. Chem. 1987, 91 (11): 2675–2678. doi:10.1021/j100295a001.
- ^ Hydrocarbon Chemistry, George A. Olah, Arpad Molner, 2d edition, 2003, Wiley-Blackwell ISBN 978-0471417828
- ^ Finn, Patricia; Jolly, William L. Asymmetric cleavage of diborane by water. The structure of diborane dihydrate. Inorganic Chemistry. August 1972, 11 (8): 1941–1944 [2020-10-21]. doi:10.1021/ic50114a043. (原始内容存档于2021-04-27).
- ^ D'Ulivo, Alessandro. Mechanism of generation of volatile species by aqueous boranes. Spectrochimica Acta Part B: Atomic Spectroscopy. May 2010, 65 (5): 360–375. doi:10.1016/j.sab.2010.04.010.
- ^ Housecroft, C. E.; Sharpe, A. G. Chapter 13: The Group 13 Elements. Inorganic Chemistry
 3rd. Pearson. 2008: 336. ISBN 978-0-13-175553-6.
3rd. Pearson. 2008: 336. ISBN 978-0-13-175553-6.
- ^ 10.0 10.1 Burkhardt, Elizabeth R.; Matos, Karl. Boron reagents in process chemistry: Excellent tools for selective reductions. Chemical Reviews. July 2006, 106 (7): 2617–2650. doi:10.1021/cr0406918.
- ^ Kollonitisch, J. Reductive Ring Cleavage of Tetrahydrofurans by Diborane. J. Am. Chem. Soc. 1961, 83 (6): 1515. doi:10.1021/ja01467a056.
- ^ Szieberth, Dénes; Szpisjak, Tamás; Turczel, Gábor; Könczöl, László. The stability of η2-H2 borane complexes – a theoretical investigation. Dalton Transactions. 19 August 2014, 43 (36): 13571–13577. PMID 25092548. doi:10.1039/C4DT00019F.
- ^ Tague, Thomas J.; Andrews, Lester. Reactions of Pulsed-Laser Evaporated Boron Atoms with Hydrogen. Infrared Spectra of Boron Hydride Intermediate Species in Solid Argon. Journal of the American Chemical Society. 1 June 1994, 116 (11): 4970–4976. doi:10.1021/ja00090a048.
- ^ Schreiner, Peter R.; Schaefer III, Henry F.; Schleyer, Paul von Ragué. The structure and stability of BH5. Does correlation make it a stable molecule? Qualitative changes at high levels of theory. The Journal of Chemical Physics. 1 June 1994, 101 (9): 7625. Bibcode:1994JChPh.101.7625S. doi:10.1063/1.468496.
- ^ A Life of Magic Chemistry: Autobiographical Reflections Including Post-Nobel Prize Years and the Methanol Economy, 159p