Meerwein芳基化反應
外觀
Meerwein芳基化反應(Meerwein arylation),由 Hans Meerwein 在1939年報道。
芳基重氮鹽在金屬鹽類存在下對缺電子烯烴的加成反應。產物為取代芳香族化合物。[1][2]

烯烴上的吸電子基團降低了烯烴雙鍵的電子密度。
反應機理
[編輯]反應的具體機理仍不清楚。[3]
有認為此反應為自由基-親核芳香取代機理。首先重氮鹽斷裂放出氮氣,生成芳基自由基,接下來芳基自由基對雙鍵進行自由基加成,產生的烷基自由基中間體被重氮鹽中的反離子如鹵素或四氟硼酸根捕獲,生成取代芳香族化合物。此產物還可繼續經過消除放出鹵化氫,從而進一步得到苯乙烯衍生物。
拓展
[編輯]1、丙烯酸與芳基重氮鹽、溴化亞銅和氫溴酸反應生成α-溴羧酸[4]
2、丁二烯經過反應首先生成4-氯-2-丁烯,再經消除,可得芳基取代的丁二烯[5]
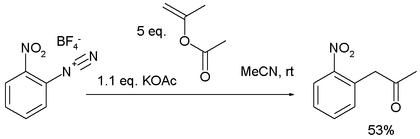
4、千克級無金屬 Meerwein 芳基化[7]
參見
[編輯]參考資料
[編輯]- ^ Meerwein, H;, Buchner, E.; van Emsterk, K. J. Prakt. Chem. 1939, 152, 237.
- ^ Minireview Intermolecular Olefin Functionalisation Involving Aryl Radicals Generated from Arenediazonium Salts Markus R. Heinrich doi:10.1002/chem.200801306 Chemistry - A European Journal 2008 Volume 15 Issue 4, Pages 820 - 833
- ^ Strategic Applications of Named Reactions in Organic Synthesis Laszlo Kurti, Barbara Czako Academic Press (March 4, 2005) ISBN 0-12-429785-4
- ^ Benzenepropanoic acid, 4-acetyl-α-bromo- Organic Syntheses, Coll. Vol. 6, p.21 (1988); Vol. 51, p.1 (1971). Link (頁面存檔備份,存於互聯網檔案館)
- ^ 1,3-Butadiene, 1-(p-nitrophenyl)- Organic Syntheses, Coll. Vol. 4, p.727 (1963); Vol. 31, p.80 (1951). Link (頁面存檔備份,存於互聯網檔案館)
- ^ 2-Butanone, 4-(4-chlorophenyl)- Organic Syntheses, Coll. Vol. 7, p.105 (1990); Vol. 62, p.67 (1984) Link (頁面存檔備份,存於互聯網檔案館).
- ^ A Practical Synthesis of -Aryl Methyl Ketones via a Transition-Metal-Free Meerwein Arylation Carmela Molinaro, Jeffrey Mowat, Francis Gosselin, Paul D. O'Shea, Jean-François Marcoux, Rémy Angelaud, and Ian W. Davies J. Org. Chem.; 2007; 72(5) pp 1856 - 1858; (Note) doi:10.1021/jo062483g
