瓦克爾法
瓦克爾法(Wacker process),又稱赫希斯特-瓦克爾法,最早是指乙烯在含有四氯鈀酸鹽催化劑的水中,被空氣中的氧氣氧化為乙醛的反應。[1][2][3][4][5][6]
這是第一個工業化的有機金屬(有機鈀)反應,亦是均相催化和配位催化中很重要的一個反應,在1960年代後發展很快,在石油化工發達的國家已大幅取代了乙炔水合法,用於從烯烴製取醛、酮類。反應中的鈀配合物與烯烴配合物蔡氏鹽類似,不過後者是一個異相催化劑。
此反應形式上與氫甲酰化反應類似,都是工業上用於醛類的反應。但兩者不同的是,氫甲酰化所用的是銠基催化劑,而且氫甲酰化是一個增碳過程。
反應機理[編輯]
反應機理見圖。
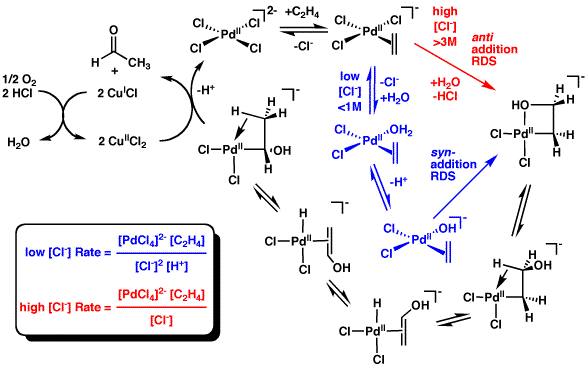
這一反應很容易發生,將乙烯和空氣通入含有銅鹽的氯化鈀(Ⅱ)-鹽酸水中,乙烯幾乎全部轉化為乙醛。而氯化鈀則被還原為鈀,在氯化銅的作用下得到再生。氯化銅被還原生成的氯化亞銅又可被空氣、純氧或其他氧化劑再氧化為二價銅。這一過程形式上可以表示為:
瓦克爾-辻氧化反應[編輯]
為氧化更複雜的底物,辻二郎發展了混合溶劑體系(DMF/H2O),又稱為「瓦克爾-辻氧化反應」。最常用的烯烴底物是末烯,反應遵循馬氏規則,得甲基酮。1,2-二取代烯烴也可反應,但區域選擇性難以控制。1,1-二取代烯烴的氧化產率低。1,3-丁二烯氧化得α,β-不飽和醛。環烯烴氧化得環酮。
例如,1-癸烯在氯化鈀和氯化銅存在下,在二甲基甲酰胺/水溶劑中,可被空氣氧化成為2-癸酮。[7]
參考資料[編輯]
- ^ 從Wacker-Verfahren -> Wacker process 翻譯而來。
- ^ F.C. Phillips, Am. Chem. J., 1894, 16, 255-277.
- ^ F.C. Phillips, Z. Anorg. Chem., 1894, 6, 213-228.
- ^ J. Smidt, W. Hafner, R. Jira, J. Sedlmeier, R. Sieber, R. Rüttinger, and H. Kojer, Angew. Chem., 1959, 71, 176-182. doi:10.1002/ange.19590710503
- ^ W. Hafner, R. Jira, J. Sedlmeier, and J. Smidt, Chem. Ber., 1962, 95, 1575-1581.
- ^ J. Smidt, W. Hafner, R. Jira, R. Sieber, J. Sedlmeier, and A. Sabel, Angew. Chem., Int. Ed. Engl., 1962, 1, 80-88.
- ^ Jiro Tsuji, Hideo Nagashima, and Hisao Nemoto, General Synthetic Method for the preparation of Methyl Ketones from Terminal Olefins: 2-Decanone[永久失效連結], Organic Syntheses, Coll. Vol. 7, p.137 (1990); Vol. 62, p.9 (1984).
|

![{\displaystyle \mathrm {[PdCl_{4}]^{2-}+C_{2}H_{4}+H_{2}O\rightarrow CH_{3}CHO+Pd+2HCl+2Cl^{-}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/1d7066b8edd4e9af725e807e187efa26d951aab9)
![{\displaystyle \mathrm {Pd+2CuCl_{2}+2Cl^{-}\rightarrow [PdCl_{4}]^{2-}+2CuCl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/e046e93791ee40713acfeeb65f8f91b7f5460386)

