亞硝鎓離子
外觀
| 亞硝鎓離子 | |
|---|---|
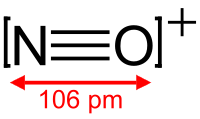
| |
| IUPAC名 Oxidonitrogen(1+) | |
| 別名 | Nitrosonium Iminooxidanium 亞硝基正離子 |
| 識別 | |
| 縮寫 | NO(+) |
| CAS號 | 14452-93-8 |
| PubChem | 84878 |
| SMILES |
|
| InChI |
|
| InChIKey | KEJOCWOXCDWNID-UHFFFAOYSA-N |
| Gmelin | 456 |
| ChEBI | 29120 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
亞硝鎓離子是化學式 NO+ 的陽離子,是電中性的一氧化氮被電離而成的。[1]它可以由亞硝酸被質子化而成。[2]

化學性質
[編輯]水解
[編輯]NO+容易與水反應形成亞硝酸:
- NO++ H2O→HONO + H+
因此,亞硝鎓鹽必須防止水分甚至潮濕的空氣。亞硝鎓鹽和鹼反應產生亞硝酸鹽:
- NO++ 2 NaOH→NaNO2+ Na++ H2O
作為重氮化試劑
[編輯]NO+與芳基胺ArNH2反應,得到重氮鹽ArN+
2。
作為氧化劑
[編輯]芳香烴的亞硝醯化
[編輯]親電子的芳香烴可以被 NOBF4 亞硝醯化。[4] 這是一個涉及苯甲醚的例子:
- CH3OC6H5 + NOBF4 → CH3OC6H4NO + HBF4
作為亞硝醯配合物的來源
[編輯]NOBF4 和羰基配合物反應,形成對應的亞硝醯配合物。[5]
- (C6Et6)Cr(CO)3 + NOBF4 → [(C6Et6)Cr(CO)2(NO)]BF4 + CO
參考資料
[編輯]- ^ Jürgen Falbe, Manfred Regitz, Römpp Chemie Lexikon. 9, Stuttgart: Georg Thieme Verlag. 1990: pp. 3028, (德文)
- ^ Jonathan Clayden, Nick Greeves, Stuart Warren, Organische Chemie. 2, Berlin Heidelberg: Springer Spektrum. 2013: pp. 513, (德文)
- ^ N. G. Connelly, W. E. Geiger. Chemical Redox Agents for Organometallic Chemistry. Chem. Rev. 1996, 96 (2): 877–910. PMID 11848774. doi:10.1021/cr940053x.
- ^ E. Bosch and J. K. Kochi. "Direct Nitrosation of Aromatic Hydrocarbons and Ethers with the Electrophilic Nitrosonium Cation". Journal of Organic Chemistry, 1994, volume 59, pp. 5573–5586.
- ^ T. W. Hayton, P. Legzdins, W. B. Sharp. "Coordination and Organometallic Chemistry of Metal-NO Complexes". Chemical Reviews 2002, volume 102, pp. 935–991.
