氧的氟化物

氧的氟化物是一类只由氧和氟组成的化合物,通式OnF2(n = 1 至 6)。一共有七种氧的氟化物被发现:
- 二氟化氧 (OF2)
- 二氟化二氧 (O2F2)
- 二氟化三氧,又称二氟化臭氧(O3F2)[1][2]
- 二氟化四氧(O4F2)[3]
- 二氟化五氧(O5F2)
- 二氟化六氧(O6F2)[4]
- 一氟化二氧自由基(O2F)

氧的氟化物是具有高能量的强氧化剂,可以瞬时或以受控的速率释放其能量。因此,这些化合物作为喷气推进系统中的潜在燃料备受关注。[5]
性质[编辑]
这里有三种最常见的氧的氟化物 – 二氟化氧 (OF2), 二氟化二氧(O2F2) 和二氟化三氧(O3F2)的性质。
二氟化氧(OF2)[编辑]

二氟化氧的一般制备方法是用氟单质氟化氢氧化钠而成:
OF2 是一种无色气体,在128 K以下是一种黄色液体。它有一种不愉快的恶臭,并且有毒。[3] 它可以和氢卤酸反应,生成相应的卤素单质:
它也可以替代卤化物里的卤素离子,生成氟化物。[3] 它是一种高效的氟化剂和强氧化剂。当和不饱和的氮的氟化物(例如:四氟肼)放电时,会产生三氟化氮和氮氧化物。[6][7]
二氟化二氧(O2F2)[编辑]
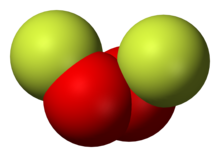
O2F2 是一种橙色固体,由液态 O2 和 F2 在 -196 °C照射紫外光而成。[8] 它只在-160 °C 以下稳定。[9] 氧的氟化物都是由氧气和氟气放电而成,O2F2 也不例外。[10]
它是一种橙色固体,极易分解成 O2 和 F2 ,温度接近于沸点 216 K。[3]
O2F2 可以和红磷反应, 即使在 -196 °C 仍会爆炸。三氟氯甲烷可以用来减缓爆炸力度。[9]
二氟化三氧(O3F2)[编辑]
O3F2 是一种血红色液体。它在 90 K 就是液体,与熔点 109 K 的O2F2不同,可用来分辨两者。[11][3]
和其他氧的氟化物一样, O3F2 极易分解,于 115 K 迅速分解,反应如下:
参考资料[编辑]
- ^ Solomon, I. J. et al. Additional Studies Concerning the Existence of O3F2. Journal of the American Chemical Society. 1968, 90 (20): 5408–5411. doi:10.1021/ja01022a014.
- ^ Misochko, Eugenii Ya, Alexander V. Akimov, Charles A. Wight. Infrared spectroscopic observation of the stabilized Intermediate complex FO3 formed by reaction of mobile Fluorine atoms with ozone molecules Trapped in an Argon Matrix. The Journal of Physical Chemistry A. 1999, 103 (40): 7972–7977. Bibcode:1999JPCA..103.7972M. doi:10.1021/jp9921194.
- ^ 3.0 3.1 3.2 3.3 3.4 Streng, A. G. The Oxygen Fluorides. Chemical Reviews. 1963, 63 (6): 607–624. doi:10.1021/cr60226a003.
- ^ Streng, A. G., A. V. Grosse. Two New Fluorides of Oxygen, O5F2 and O6F2. Journal of the American Chemical Society. 1966, 88: 169–170. doi:10.1021/ja00953a035.
- ^ Jäger, Susanne et al. Fluorine and Oxygen. Fluorine. Berlin, Heidelberg: Springer. 1986: 1–161.
- ^ Nikitin, Igor Vasil'evich, and V. Ya Rosolovskii. Oxygen Fluorides and Dioxygenyl Compounds. Russian Chemical Reviews. 1971, 40 (11): 889–900. Bibcode:1971RuCRv..40..889N. doi:10.1070/rc1971v040n11abeh001981.
- ^ Lawless, Edward W., Ivan C. Smith. Inorganic high-energy oxidizers: synthesis, structure, and properties. M. Dekker. 1968.
- ^ Marx, Rupert, Konrad Seppelt. Structure investigations on oxygen fluorides. Dalton Transactions. 2015, 44 (45): 19659–19662. PMID 26351980. doi:10.1039/c5dt02247a.
- ^ 9.0 9.1 Solomon, Irvine J. Research on Chemistry of and . No. IITRI-C227-6. IIT RESEARCH INST CHICAGO IL, 1964.
- ^ Goetschel, Charles T. et al. Low-Temperature Radiation Chemistry. I. Preparation of Oxygen Fluorides and Dioxygenyl Tetrafluoroborate. Journal of the American Chemical Society. 1969, 91 (17): 4702–4707. doi:10.1021/ja01045a020.
- ^ De Marco, Ronald A., and Jean'ne M. Shreeve . "Fluorinated Peroxides." Advances in Inorganic Chemistry and Radiochemistry. Vol. 16. Academic Press, 1974. 109-176.



![{\displaystyle {\ce {{O2}+F2->[{\text{放电}}][{\text{183 °C}}]O2F2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5cb95a6cdb31a300cbad001b13117e3f394a0741)


