[2,3]-威悌重排反應
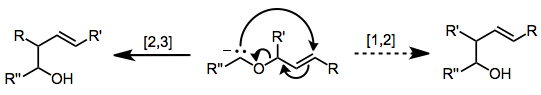
[2,3]-威悌重排反應是將一個烯丙基醚轉換成一個高烯丙醇的協同周環反應。該反應屬於協同反應,因此具有較高的立體選擇性,可以在合成途徑前期用於構建手性中心。不過因為關鍵中間體有着碳負的結構,威悌重排需要強鹼性條件。[1,2]-威悌重排反應是其競爭反應。[1]
產生異構戊-5-烯-1-醇的[1,2]-威悌重排是一種在高溫下發生的競爭過程。[2]由於[2,3]-威悌重排的高原子經濟性和立體選擇性,它已經獲得了相當大的合成效用。碳陰離子通過中等酸性底物的直接鋰化,錫金屬轉移反應或O,S-縮醛的還原鋰化而產生。使用手性起始材料的立體選擇性方法已被用於實現不對稱誘導或簡單的非對映選擇[3]
(1)

機理與立體化學[編輯]
優勢機理[編輯]
碳負離子形成後,在低溫下有選擇性地發生[2,3]-威悌重排,且反應速率較快。然而,如果反應體系的溫度達到-60°C以上,則主要發生[1,2]重排。[4]
(2)
假定的過渡態具有五元包絡狀結構。[5] 連接陰離子的基團(G)能夠佔據假平鍵或假立鍵的位置,而前者通常佔優。為避免產生烯丙位張力,在乙醚氧另一側的大取代基傾向於佔據外型位置(RE)。These restrictions lead to a preference for the syn product from (Z) isomers and anti products from (E) isomers; however, some exceptions to this rule are known.[6]
(3)

立體選擇性變體[編輯]
簡介[編輯]
[2,3]-σ遷移重排發生在很多不同的X和Y基團之間(見下圖)。當X是一個碳負離子,Y是一個醇鹽時,該重排就被稱為[2,3]-威悌重排反應。[2]
(1)

實驗條件和步驟[編輯]
典型條件[編輯]
重排必須在低於-60°C的溫度下進行,以避免競爭性的 [1,2] - 重排。 通常,用正丁基鋰簡單地處理基質足以引起重排。 涉及丁基鋰的反應應在氮氣或氬氣下進行,嚴格無水。
參考資料[編輯]
- ^ Nakai, T.; Mikami, K. The [2,3]-Wittig Rearrangement. Organic Reactions. 2004. ISBN 0471264180. doi:10.1002/0471264180.or046.02.
- ^ 2.0 2.1 Baldwin, J. E.; Patrick, J. E. Stereochemistry of [2,3]-sigmatropic reactions. Wittig rearrangement. J. Am. Chem. Soc. 1971, 93 (14): 3556. doi:10.1021/ja00743a060.
- ^ Nakai, T.; Mikami, K.; Taya, S.; Fujita, Y. [2,3]-Wittig rearrangement of unsymmetrical bis-allylic ethers. Facile method for regio- and stereoselective synthesis of 1,5-dien-3-ols. J. Am. Chem. Soc. 1981, 103 (21): 6492. doi:10.1021/ja00411a038.
- ^ Schollkopf, U.; Fellenberger, K.; Rizk, M. 1.2-Wanderungen zum Atom mit freiem Elektronenpaar, VIII.ortho-Isomerisation bei anionisierten Äthern und Wanderungsmechanismus eines Propargyl-Restes bei der Wittig-Umlagerung. Justus Liebigs Ann. Chem. 1970, 734: 106. doi:10.1002/jlac.19707340111.
- ^ Mikami, K.; Kimura, Y.; Kishi, N.; Nakai, T. Acyclic diastereoselection of the [2,3]-Wittig sigmatropic rearrangement of a series of isomeric crotyl ethers. A conceptual model for the transition-state geometry. J. Org. Chem. 1983, 48 (2): 279. doi:10.1021/jo00150a033.
- ^ Still, W. C.; Mitra, A. A highly stereoselective synthesis of Z-trisubstituted olefins via [2,3]-sigmatropic rearrangement. Preference for a pseudoaxially substituted transition state. J. Am. Chem. Soc. 1978, 100 (6): 1927. doi:10.1021/ja00474a049.
