烯醇硅醚

硅烯醇醚(Silyl enol ether),又称烯醇硅醚,是烯醇醚中氧原子上的基团为硅基取代形成的一类化合物。烯醇硅醚是烯醇的稳定形式,热稳定性较高,是有机合成中的重要中间体。
合成
[编辑]烯醇硅醚一般由用含硅-卤键的化合物(如氯硅烷)与醛、酮在弱碱存在下反应或捕获醛、酮去质子化生成的烯醇负离子得到。[1][2]
1、使用 TMSCl/Et3N/DMF 体系制备:在 Et3N / DMF 体系中,用醛酮与 TMSCl 反应生成三甲硅烯醇醚。用叔丁基二甲基氯硅烷也可以得到相应的叔丁基二甲基硅基烯醇醚。
Si-O键键能很高,羰基化合物与三甲氯硅烷反应时,不需加入强碱,羰基化合物中少量存在的烯醇式就可以与三甲基氯硅烷反应,而反应后只要用弱碱如三乙胺处理,便可得到烯醇硅醚。[3]氯硅烷中的硅原子对氧有高度的亲电性。该反应可能的机理有如下两种:[3]

不对称酮与三甲基硅基化合物作用时产生两种烯醇硅醚的混合物,并以热力学控制产物即较稳定的多取代烯烃为主要产物。对于有些酮类如樟脑就不能用三甲基氯硅烷,而需要采用三氟甲磺酸三甲硅基酯(CF3SO3SiMe3)作为生成烯醇硅醚的试剂。
2、使用强碱/TMSCl 体系制备:用非亲核性的强碱如LDA或NaHMDS,与酮作用生成相应的烯醇负离子,并用 TMSCl 捕获它,也可以制得烯醇硅醚。如果酮是不对称酮,则主要生成动力学控制的产物。
例如,三甲硅烯醇醚可由三甲基氯硅烷与用LDA处理酮后产生的烯醇负离子作用得到:

3、金属还原法:酯与金属钠、TMSCl 在甲苯中反应,生成酯的双分子还原产物——烯二醇的双硅醚,此双硅醚又可在酸性条件下水解得到偶姻缩合产物:

此外也可以通过α,β-不饱和羰基化合物的1,4-硅氢化反应[4]


反应
[编辑]水解:生成相应的羰基化合物,硅基最终转变为六甲基二硅氧烷:

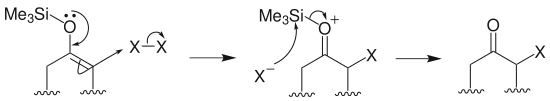
烷基化:烯醇硅醚在路易斯酸四氯化钛存在下与叔卤代烃或者酯类化学物反应,生成α-烃基酮:

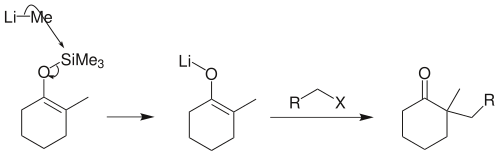
若反应物是伯卤代烃,须先将烯醇硅醚转化为烯醇负离子锂盐,才能顺利地在α-位上发生烷基化:
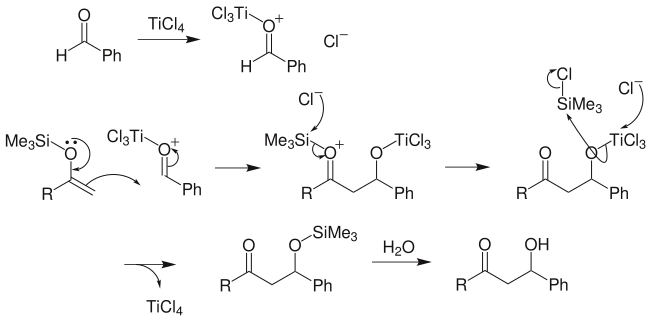
向山羟醛反应:先将某一酮制成三甲硅基烯醇醚,再与另一分子酮发生羟醛反应,可得到预期的β-羟基酮,并且避免了交叉缩合的众多副产物的产生:
Diels-Alder反应:烯醇硅醚中的三甲基硅基的供电性有利于双烯体的D-A反应。Danishefsky双烯就是作为双烯体参与D-A反应的烯醇硅醚的一个例子。
Rubottom氧化反应:被mCPBA氧化得到硅基保护的α-羟基酮:[7]

Saegusa氧化反应:某些烯醇硅醚被乙酸钯(II)氧化为α,β-不饱和羰基化合物。

烯酮硅基缩酮
[编辑]烯酮硅基缩酮(Ketene silyl acetal)是一类有 R-C=C(OSiR3)(OR') 结构的烯醇硅醚,其亲核性比普通的烯醇硅醚更强,可以较快地与α,β-不饱和羰基化合物起反应。
制备:

反应:
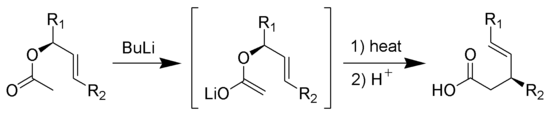
Ireland-Claisen重排反应:烯酮硅基缩酮发生[3,3]σ迁移反应重排,水解后得到γ,δ-不饱和羧酸:
参见
[编辑]参考资料
[编辑]- ^ Organic Syntheses, Coll. Vol. 9, p.564 (1998); Vol. 73, p.123 (1996) Article (页面存档备份,存于互联网档案馆)
- ^ Organic Syntheses, Coll. Vol. 8, p.277 (1993); Vol. 66, p. 43 (1988) Article (页面存档备份,存于互联网档案馆).
- ^ 3.0 3.1 J. P. Clayden, N. Greeves, S. G. Warren, P. D. Wothers (2000), Organic Chemistry (1st ed.), Oxford: Oxford University Press, p. 540, ISBN 978-0-19-850346-0
- ^ Masahiro Anada, Masahiko Tanaka, Kanami Suzuki, Hisanori Nambu, and Shunichi Hashimoto. Dirhodium(II) Tetrakis(perfluorobutyrate)-Catalyzed 1,4-Hydrosilylation of α,β-Unsaturated Carbonyl Compounds (PDF). Chem. Pharm. Bull. 2006, 54 (11): 1622–1623 [2022-01-12]. (原始内容存档 (PDF)于2018-07-22).
- ^ R. Tong, F. E. McDonald, Angewandte Chemie, Int. Ed. 2008, 47, 1-4.
- ^ Organic Syntheses, Coll. Vol. 8, p.286 (1993); Vol. 69, p.129 (1990) Article (页面存档备份,存于互联网档案馆)
- ^ Organic Syntheses, Coll. Vol. 7, p.282 (1990); Vol. 64, p.118 (1986) Article (页面存档备份,存于互联网档案馆).
