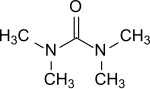
四甲基脲
| 四甲基脲 | |
|---|---|
| |
| IUPAC名 Tetramethylurea | |
| 别名 | 1,1,3,3-四甲基脲 TMU |
| 识别 | |
| CAS号 | 632-22-4 |
| PubChem | 12437 |
| ChemSpider | 11930 |
| SMILES |
|
| ChEBI | 84278 |
| 性质 | |
| 化学式 | C5H12N2O |
| 摩尔质量 | 116.16 g·mol−1 |
| 外观 | 无色液体 |
| 密度 | 0.968 g/mL |
| 熔点 | -1.2 °C(272 K) |
| 沸点 | 176.5 °C(450 K) |
| 危险性 | |
GHS危险性符号 
| |
| GHS提示词 | Danger |
| H-术语 | H302, H360, H361 |
| P-术语 | P201, P202, P264, P270, P281, P301+312, P308+313, P330, P405, P501 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
四甲基脲是一种有机化合物,化学式 (Me2N)2CO。它是一种脲类化合物。这种无色液体可用作极性非质子溶剂。
制备
[编辑]四甲基脲的制备方法及性质已被描述。[1]
二甲胺和光气在50% 氢氧化钠溶液存在下反应可以得到可用1,2-二氯乙烷提取的四甲基脲,产率95%。[2]


二甲胺基甲酰氯和无水碳酸钠反应也可以生成四甲基脲,产率96.5%。[3]
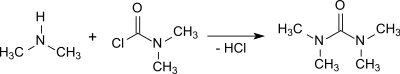
四甲基脲也可以通过二甲胺基甲酰氯和大量的二甲胺反应而成。虽然产物受污染且很臭,但其中的四甲基脲可以通过氧化钙和分馏提纯。[4]
四甲基脲也可以通过四(二甲胺基)乙烯(TDAE)的氧化而成。四(二甲胺基)乙烯是一种富电子的烯烃[5]和强还原剂,可以由三(二甲氨基)甲烷的热分解[6]或是三氟氯乙烯和二甲胺反应而成。[7]

四(二甲胺基)乙烯(TDAE)会和氧气产生(2+2) 环加成反应,形成1,2-二氧四环化合物,而这种化合物会分解成激发态的四甲基脲。激发态的四甲基脲回到基态时会放出波长515 nm的绿光。[8][9]

性质
[编辑]四甲基脲是一种清澈无色液体,有温和的芳香气味,混溶于水和许多有机溶剂。[10]虽然四甲基脲是一种脲类化合物,但它有不寻常高(> 170 °C)的液态范围。
应用
[编辑]四甲基脲和很多有机化合物都可以混溶,包括像是乙酸的酸和像是吡啶的碱,也是如己内酰胺或苯甲酸的有机化合物的优良溶剂,甚至可以溶解一些无机化合物,如硝酸银或碘化钠。[11][12]由于其独特的溶剂特性,四甲基脲通常用作致癌物六甲基磷酰胺(HMPT)的替代品。[13]
4-氨基苯甲酰氯盐酸盐在四甲基脲中聚合会产生聚(对苯甲酰胺)(PPB)的各向同性粘性溶液,可直接纺织成纤维。[14]

在四甲基脲和氯化锂的混合物中,可以获得高达14% PPB聚合物的稳定各向同性溶液。[15]
在较高的温度下,四甲基脲还可以溶解纤维素酯并溶胀其他聚合物,例如聚碳酸酯、聚氯乙烯或脂肪族聚酰胺。[1]
受阻的胍类非亲核碱可以通过简单的方式从四甲基脲制备[16][17]。

危害
[编辑]四甲基脲的急性毒性中等。然而,它对几种动物具有胚胎毒性和致畸性。[18]
参考资料
[编辑]- ^ 1.0 1.1 A. Lüttringhaus; H.-W. Dirksen, Tetramethylharnstoff als Lösungsmittel und Reaktionspartner, Angew. Chem. 75 (22), 1963, 75 (22): 1059–1068, doi:10.1002/ange.19630752204 (德语)
- ^ US 3681457,H. Babad,「Method of making tetramethylurea」,发表于1972-8-1
- ^ J.K. Lawson Jr.; J.A.T. Croom, Dimethylamides from alkali carboxylates and dimethylcarbamoyl chloride, J. Org. Chem. 28 (1), 1963, 28 (1): 232–235, doi:10.1021/jo01036a513 (德语)
- ^ US 3597478,M.L. Weakly,「Preparation of tetramethylurea」,发表于1971-8-3
- ^ H. Bock; H. Borrmann; Z. Havlas; H. Oberhammer; K. Ruppert; A. Simon, Tetrakis(dimethylamino)ethen: Ein extrem elektronenreiches Molekül mit ungewöhnlicher Struktur sowohl im Festkörper als auch in der Gasphase, Angew. Chem. 103 (12), 1991, 103 (12): 1733–1735, doi:10.1002/ange.19911031246 (德语)
- ^ H. Weingarten; W.A. White, Synthesis of Tetrakis(dimethylamino)ethylene, J. Org. Chem. 31 (10), 1966, 31 (10): 3427–3428, doi:10.1021/jo01348a520 (德语)
- ^ US 3293299,H. Boden,「Process for making tetrakis(dimethylamino)ethylene」,发表于1966-12-20
- ^ H.E. Winberg; J.R. Downing; D.D. Coffman, The chemiluminescence of tetrakis(dimethylamino)ethylene, J. Am. Chem. Soc. 87 (9), 1965, 87 (9): 2054–2055, doi:10.1021/ja01087a039 (德语)
- ^ Chemilumineszenz von TDAE. illumina-chemie.de. 2014-08-08 [2016-08-22]. (原始内容存档于2020-02-04) (德语).
- ^ R.M. Giuliano. Tetramethylurea. Encyclopedia of Reagents for Organic Synthesis. 2004. ISBN 978-0471936237. doi:10.1002/047084289X.rn00399.
- ^ B.J. Barker; J.A. Caruso, The Chemistry of Nonaqueous Solvents, IV. Solution Phenomena and Aprotic Solvents, New York: Academic Press: 110–127, 1976, ISBN 978-0-12-433804-3 (德语)
- ^ B.J. Barker; J. Rosenfarb; J.A. Caruso, Harnstoffe als Lösungsmittel in der chemischen Forschung, Angew. Chem. 91 (7), 1979, 91 (7): 560–564, doi:10.1002/ange.19790910707 (德语)
- ^ A.J. Chalk, The use of sodium hydride as a reducing agent in nitrogen-containing solvents I. The reduction of chlorosilanes in Hexaalkylphosphoric triamides and tetraalkylureas, J. Organomet. Chem. 21 (1), 1970, 21 (1): 95–101, doi:10.1016/S0022-328X(00)90598-9 (德语)

- ^ J. Preston, A. Blumstein , 编, Synthesis and Properties of Rodlike Condensation Polymers, in Liquid Crystalline Order in Polymers, New York: Academic Press: 141–166, 1978, ISBN 978-0-12-108650-3 (德语)
- ^ S.L. Kwolek; P.W. Morgan; J.R. Schaefgen; L.W. Gulrich, Synthesis, Anisotropic Solutions, and Fibers of Poly(1,4-benzamide), Macromolecules 10 (6), 1977, 10 (6): 1390–1396, Bibcode:1977MaMol..10.1390K, doi:10.1021/ma60060a041 (德语)
- ^ (1997) "Preparation and Reactions of 2-tert-butyl-1,1,3,3-tetramethylguanidine: 2,2,6-trimethylcyclohexen-1-yl iodide". Org. Synth. 74.
- ^ D.H.R. Barton; J.D. Elliott; S.D. Géro, The synthesis and properties of a series of strong but hindered organic bases, J. Chem. Soc., Chem. Commun. (21), 1981, (21): 1136–1137, doi:10.1039/C39810001136 (德语)
- ^ The MAK Collection for Occupational Health and Safety, Tetramethylharnstoff [MAK Value Documentation in German language, 1979], Tetramethylharnstoff [MAK Value Documentation in German language, 1979], Documentations and Methods, Weinheim: Wiley-VCH: 1–6, 2012, ISBN 978-3527600410, doi:10.1002/3527600418.mb63222d0007
 (德语)
(德语)
