硝基化合物的还原反应
外观

硝基化合物的还原反应是一种可通过诸多不同试剂和不同反应条件进行的化学反应。由于硝基的还原反应非常容易发生,因此历史上硝基是首批被发现可发生还原反应的基团之一。
脂肪族硝基化合物与芳香族硝基化合物在还原反应上表现出较大的差异,因此可将这类反应分类为:脂肪族硝基化合物的还原反应与芳香族硝基化合物的还原反应,第二级分类则通过还原试剂的种类进行分类。
脂肪族硝基化合物
[编辑]氢化脱硝反应(硝基被氢所取代)很难达成,需要通过在硅胶上分散的钯试剂并在高温的条件下才可发生。[1]
脂肪族硝基化合物可以通过下列几种试剂还原为脂肪族的胺类化合物:
α,β-不饱和硝基化合物可通过下列方法还原为饱和胺类化合物:
硝基化合物通常可被一些低价无机盐还原为肟类化合物,如:氯化锡[8]或二氯化铬。[9] 另外,通过控制氢气的量进行的硝基化合物的催化氢化反应,也同样可以得到肟类化合物[10]
芳香族硝基化合物
[编辑]芳香硝基化合物的还原反应通常收率很高,并可用于多种有机化合物的合成反应,相比脂肪族硝基化合物的还原反应,芳香族硝基化合物的还原反应更具应用意义。
通过芳香硝基化合物来合成芳香胺,有诸多方法:
- 利用钯碳,二氧化铂或雷尼镍催化剂进行催化氢化反应[11] [12]
- 利用铁单质,在含有醋酸的溶剂中进行还原反应[13] (注:铁粉因其价格低廉,对于大多数官能团耐受且条件温和,常用于实验室内的硝基化合物的还原反应。但铁粉因为环境污染及后处理纯化的不易,在工业生产中用途并不广泛,参见Bechamp还原反应)。
- 连二亚硫酸钠[14]
- 硫化钠或硫化氢
- 二氯化锡[15]
- 三氯化钛
- 锌单质
- 钐[16]
还可以通过硫化钠还原二硝基芳香化合物,以制备硝基芳香胺类化合物。[17]
硝基化合物可利用金属氢化物的还原性,发生还原反应制备偶氮化合物。
下列为常用的芳香硝基化合物还原为羟氨的方法:
通过过量的锌单质,将芳香硝基化合物转化为N,N'-二芳基肼。[21]
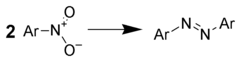
通过金属氢化物还原芳香硝基化合物,可以高收率的得到偶氮化合物。例如:
参考文献
[编辑]- ^ M. J. Guttieri and W. F. Maier. Selective cleavage of carbon-nitrogen bonds with platinum. J. Org. Chem. 1984, 49 (16): 2875–2880. doi:10.1021/jo00190a006.
- ^ A. T. Nielsen. The Isomeric Dinitrocyclohexanes. II. Stereochemistry. J. Org. Chem. 1962, 27 (6): 1998–2001. doi:10.1021/jo01053a019.
- ^ Dauben, Jr., H. J.; Ringold, H. J.; Wade, R. H.; Pearson, D. L.; Anderson, Jr., A. G. (1963). "Cycloheptanone". Org. Synth.; Coll. Vol. 4: 221.
- ^ Senkus, M. Ind. Eng. Chem. 40: 506. 1948.
- ^ A. S. Kende and J. S. Mendoza. Controlled reduction of nitroalkanes to alkyl hydroxylamines or amines by samarium diiodide. Tetrahedron Letters. 1991, 32 (14): 1699–1702. doi:10.1016/S0040-4039(00)74307-3.
- ^ A. Burger, M. L. Stein and J. B. Clements. Some Pyridylnitroalkenes, Nitroalkanols, and Alkylamines. J. Org. Chem. 1957, 22 (2): 143–144. doi:10.1021/jo01353a010.
- ^ H. Feuer, R. S. Bartlett, B. F. Vincent and R. S. Anderson. Diborane Reduction of Nitro Salts. A New Synthesis of N-Monosubstituted Hydroxylamines. J. Org. Chem. 1965, 30 (9): 2880–2882. doi:10.1021/jo01020a002.
- ^ Braun, V. J.; Sobecki, W. Über primäre Dinitro-, Nitronitrit- und Dialdoxim-Verbindungen der Fettreihe. Ber. 1911, 44 (3): 2526–2534. doi:10.1002/cber.19110440377.
- ^ J. R. Hanson and E. Premuzic. Applications of chromous chloride--II : The reduction of some steroidal nitro-compounds. Tetrahedron. 1967, 23 (10): 4105–4110. doi:10.1016/S0040-4020(01)97921-9.
- ^ C. Grundmann. Über die partielle Reduktion von Nitro-cyclohexan. Angewandte Chemie. 1950, 62 (23-24): 558–560. doi:10.1002/ange.19500622304.
- ^ Bavin, P. M. G. (1973). "2-Aminofluorene". Org. Synth.; Coll. Vol. 5: 30.
- ^ Allen, C. F. H.; VanAllan, J. (1955)). "2-Amino-p-cymene". Org. Synth.; Coll. Vol. 3: 63.
- ^ Fox, B. A.; Threlfall, T. L. (1973). "2,3-Diaminopyridine". Org. Synth.; Coll. Vol. 5: 346.
- ^ Redemann, C. T.; Redemann, C. E. (1955). "5-Amino-2,3-dihydro-1,4-phthalazinedione". Org. Synth.; Coll. Vol. 3: 69.
- ^ Faul, Margaret M.; Thiel, Oliver R. Encyclopedia of Reagents for Organic Synthesis. Encyclopedia of Reagents for Organic Synthesis. 2005. ISBN 9780470842898. doi:10.1002/047084289X.rt112.pub2.
|chapter=被忽略 (帮助) - ^ Basu, M. K. Ultrasound-promoted highly efficient reduction of aromatic nitro compounds to the aromatic amines by samarium/ammonium chloride. Tet. Lett. 2000, 41 (30): 5603. doi:10.1016/S0040-4039(00)00917-5.
- ^ Hartman, W. W.; Silloway, H. L. (1955). "2-Amino-4-nitrophenol". Org. Synth.; Coll. Vol. 3: 82.
- ^ Ayyangar, N. R.; Brahme, K. C.; Kalkote, U. R.; Srinivasan, K. V. Facile Transfer-Reduction of Nitroarenes to N Arylhydroxylamines with Hydrazine in the Presence of Raney Nickel. Synthesis. 1984, 1984 (11): 938. doi:10.1055/s-1984-31027.
- ^ Harman, R. E. (1963). "Chloro-p-benzoquinone". Org. Synth.; Coll. Vol. 4: 148.
- ^ Kamm, O. (1941). "β-Phenylhydroxylamine". Org. Synth.; Coll. Vol. 1: 445.
- ^ 21.0 21.1 Bigelow, H. E.; Robinson, D. B. (1955). "Azobenzene". Org. Synth.; Coll. Vol. 3: 103.
- ^ R. F. Nystrom and W. G. Brown. Reduction of Organic Compounds by Lithium Aluminum Hydride. III. Halides, Quinones, Miscellaneous Nitrogen Compounds. J. Am. Chem. Soc. 1948, 70 (11): 3738–3740. doi:10.1021/ja01191a057.