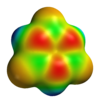
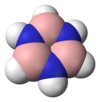
环硼氮烷
| 环硼氮烷 | |||
|---|---|---|---|

| |||
| |||
| IUPAC名 1,3,5,2,4,6-Triazatriborinane 1,3,5,2,4,6-三氮杂三硼烷(仅预选[1]) | |||
| 别名 | 环硼氮六烷 硼氮六环 无机苯 硼嗪 | ||
| 识别 | |||
| CAS号 | 6569-51-3 | ||
| PubChem | 138768 | ||
| ChemSpider | 122374 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | BGECDVWSWDRFSP-UHFFFAOYAU | ||
| ChEBI | 33119 | ||
| 性质 | |||
| 化学式 | B3H6N3 | ||
| 摩尔质量 | 80.50 g·mol⁻¹ | ||
| 外观 | 无色液体 | ||
| 密度 | 0.81 g/cm3 | ||
| 熔点 | −58 °C(215 K) | ||
| 沸点 | 53 °C(326 K) | ||
| 磁化率 | -49.6·10−6 cm3/mol | ||
| 危险性 | |||
| NFPA 704 | |||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
环硼氮烷(英语:Borazine)是一种非极性[2]的无机化合物,化学式为B3N3H6。该环状化合物的结构中有三个B-H单元和三个N-H单元交替出现。它是苯的等电子体,故有时被称为无机苯。与苯一样,环硼氮烷是一种具有芳香气味的无色液体。[3]
合成
[编辑]在1926年,化学家Alfred Stock和Erich Pohland通过乙硼烷与氨的反应合成了环硼氮烷。[4]
环硼氮烷可以通过乙硼烷和氨按1:2比例在250-300°C下反应合成,转化率为50%。
- 3 B2H6 + 6 NH3 → 2 B3H6N3 + 12 H2
- 6 NaBH4 + 3 (NH4)2SO4 → 2 B3N3H6 + 3 Na2SO4 + 18 H2
在两步法中,三氯化硼先转化为三氯环硼氮烷:
- 3 BCl3 + 3 NH4Cl → B3Cl3H3N3 + 9 HCl
再使用硼氢化钠还原:
- 2 B3Cl3H3N3 + 6 NaBH4 → 2 B3H6N3 + 3 B2H6 + 6 NaCl
结构
[编辑]环硼氮烷与苯为等电子体,具有相似的性质,因此有时也被称为无机苯。由于硼和氮之间的电负性差异,它们并不完全相同。X射线晶体学结构测定表明,环硼氮烷内的键长都等于1.429Å,与苯性质相同。[6]然而,环硼氮烷并没有形成完美的六边形。硼原子的键角为117.1°,氮原子的键角为122.9°,使分子具有D3h对称点群。
与氮的电负性(鲍林标度3.04)相比,硼的电负性(2.04)以及硼的缺乏电子和氮的孤对电子有利于环硼氮烷的内消旋体结构。

芳香性
[编辑]由于环硼氮烷与苯的相似性,因此对其芳香性进行了许多计算和实验分析。环硼氮烷的π电子数遵从4n+2规则,B-N键长相等,表明其可能是芳香族化合物。然而硼和氮之间的电负性差异导致电荷共享不均,从而导致键具有更大的离子特性,因此预计其电子离域比全碳类似物差。环硼氮烷的标准生成焓变化量ΔHf为−531 kJ/mol,热稳定性非常好。
自然键轨道
[编辑]自然键轨道理论(NBO)分析表示环硼氮烷中的芳香性较弱。[7]在NBO模型中,环中的B-N键略微偏离原子核轴,B和N的电荷差异较大。核独立化学位移(NCS)分析提供了一些进一步的证据,证明基于B-N π键对磁屏蔽的贡献的芳香性。基于NBO轨道的计算表明,该 π 键允许产生微弱的环电流,在一定程度上抵消了环硼氮烷中心模拟的磁场。一个小的环电流确实表明存在一些离域现象。
电子局域函数
[编辑]电子局域函数(ELF)对环硼氮烷中的成键进行拓扑分析,表明环硼氮烷可以认为是芳香族化合物。然而,基于电子盆地的分叉值差异,环硼氮烷中的键合比苯的键合离域性更差。较大的分叉值表示电子离域性较好,有人认为当该分岔值大于0.70时,其离域性就足以指定化合物为芳香族化合物。[8]对于苯,该值为0.91,但环硼氮烷的π系统在ELF值为0.682时分叉。[9]这是由于B和N之间的电负性差异,产生键的相互作用力比苯中C-C的相互作用力弱,导致电子在B-H和N-H单元上的定域化增加。分叉值略低于0.70的极限值,表明其有中等的芳香性。
性质与用途
[编辑]水解
[编辑]环硼氮烷很容易水解,生成硼酸、氨和氢气。
聚合
[编辑]
在70°C下加热环硼氮烷会放出氢气并形成聚环硼氮烷:
- n B3N3H6 → [B3N3H4]n
卤化氢和卤素
[编辑]- B3N3H6 + 3 HCl → B3Cl3N3H9
- 环硼氮烷与氯化氢的加成反应
- B3Cl3N3H9 + NaBH4 → (BH4N)3
- 使用硼氢化钠还原
环硼氮烷与溴的加成反应无需催化剂。其对硼进行亲核攻击,对氮进行亲电攻击。
陶瓷前体
[编辑]环硼氮烷也是其他潜在陶瓷的起始材料,例如碳氮化硼。环硼氮烷也可用作前体,在铜[10]、铂[11]、镍[12]、铁[13]等催化表面使用化学气相沉积法(CVD)生长六方氮化硼(h-BN)薄膜和单层。

其他用途
[编辑]聚环硼氮烷已被提议作为氢燃料电池汽车应用的回收储氢介质,使用“单罐”工艺进行消化和还原以重新生成硼烷氨。[14]
在其他B-N型化合物中,混合的氨基-硝基取代环硼氮烷已被预测优于碳基炸药,如CL-20。[15][16]
参考资料
[编辑]- ^ Front Matter. Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014: 968. ISBN 978-0-85404-182-4. doi:10.1039/9781849733069-FP001.
- ^ Nelson, Ralph; et al. Selected values of electric dipole moments for molecules in the gas phase (PDF). American National Bureau of Standards. September 1, 1967, (10): 17 [2023-01-25]. (原始内容存档 (PDF)于2018-06-08).
- ^ Duward Shriver; Peter Atkins. Inorganic Chemistry Fifth. New York: W. H. Freeman and Company. 2010: 328. ISBN 978-1429218207.
- ^ Stock A, Pohland E. Borwasserstoffe, VIII. Zur Kenntnis des B2H6 und des B5H11 [Boric acid solution, VIII Regarding knowledge of B2H6 and B5H11]. Berichte. October 1926, 59 (9): 2210–2215. doi:10.1002/cber.19260590906 (德语).
- ^ 5.0 5.1 Wideman, Thomas; Fazen, Paul J.; Lynch, Anne T.; Su, Kai; Remsen, Edward E.; Sneddon, Larry G. Borazine, Polyborazylene, β-Vinylborazine, and Poly(β-Vinylborazine). Borazine, Polyborazylene, β‐Vinylborazine, and Poly(β‐Vinylborazine). Inorganic Syntheses 32. 1998: 232–242. ISBN 9780470132630. doi:10.1002/9780470132630.ch39.
- ^ Boese R, Maulitz AH, Stellberg P. Solid-State Borazine: Does it Deserve to be Entitled "Inorganic Benzene"?. Chemische Berichte. 1994, 127 (10): 1887–1889. doi:10.1002/cber.19941271011.
- ^ Shen W, Li M, Li F, Wang S. Theoretical study of borazine and its derivatives. Inorg. Chim. Acta. 2007, 360 (2): 619–624. doi:10.1016/j.ica.2006.08.028.
- ^ Santos JC, Tiznado W, Contreras R, Fuentealba P. Sigma-pi separation of the electron localization function and aromaticity. The Journal of Chemical Physics. January 2004, 120 (4): 1670–3. Bibcode:2004JChPh.120.1670S. PMID 15268298. doi:10.1063/1.1635799. hdl:10533/175272
 .
.
- ^ Islas R, Chamorro E, Robles J, Heine T, Santos JC, Merino G. Borazine: to be or not to be aromatic. Struct. Chem. 2007, 18 (6): 833–839. S2CID 95098134. doi:10.1007/s11224-007-9229-z.
- ^ Kidambi PR, Blume R, Kling J, Wagner JB, Baehtz C, Weatherup RS, et al. In Situ Observations during Chemical Vapor Deposition of Hexagonal Boron Nitride on Polycrystalline Copper. Chemistry of Materials. November 2014, 26 (22): 6380–6392. PMC 4311958
 . PMID 25673919. doi:10.1021/cm502603n.
. PMID 25673919. doi:10.1021/cm502603n.
- ^ Kim G, Jang AR, Jeong HY, Lee Z, Kang DJ, Shin HS. Growth of high-crystalline, single-layer hexagonal boron nitride on recyclable platinum foil. Nano Letters. April 2013, 13 (4): 1834–9. Bibcode:2013NanoL..13.1834K. PMID 23527543. doi:10.1021/nl400559s.
- ^ Chatterjee S, Luo Z, Acerce M, Yates DM, Johnson AT, Sneddon LG. Chemical Vapor Deposition of Boron Nitride Nanosheets on Metallic Substrates via Decaborane/Ammonia Reactions. Chemistry of Materials. 2011-10-25, 23 (20): 4414–4416. ISSN 0897-4756. doi:10.1021/cm201955v (英语).
- ^ Caneva S, Weatherup RS, Bayer BC, Brennan B, Spencer SJ, Mingard K, et al. Nucleation control for large, single crystalline domains of monolayer hexagonal boron nitride via Si-doped Fe catalysts. Nano Letters. March 2015, 15 (3): 1867–75. Bibcode:2015NanoL..15.1867C. PMC 4358078
 . PMID 25664483. doi:10.1021/nl5046632.
. PMID 25664483. doi:10.1021/nl5046632.
- ^ Davis BL, Dixon DA, Garner EB, Gordon JC, Matus MH, Scott B, Stephens FH. Efficient regeneration of partially spent ammonia borane fuel. Angewandte Chemie. 2009, 48 (37): 6812–6. OSTI 960522. PMID 19514023. doi:10.1002/anie.200900680.
- ^ Koch EC, Klapötke TM. Boron-Based High Explosives.. Propellants, Explosives, Pyrotechnics. 2012, 37 (3): 335–344. doi:10.1002/prep.201100157.
- ^ Kervyn S, Fenwick O, Di Stasio F, Shin YS, Wouters J, Accorsi G, et al. Polymorphism, fluorescence, and optoelectronic properties of a borazine derivative. Chemistry. June 2013, 19 (24): 7771–9 [2023-01-25]. PMID 23616404. S2CID 9774352. doi:10.1002/chem.201204598
 . (原始内容存档于2021-02-21).
. (原始内容存档于2021-02-21).
延伸阅读
[编辑]- Sneddon LG, Mirabelli MG, Lynch AT, Fazen PJ, Su K, Beck JS. Polymeric precursors to boron based ceramics (PDF). Pure Appl. Chem. 1991, 63 (3): 407–410 [2023-01-25]. S2CID 53629042. doi:10.1351/pac199163030407. (原始内容存档 (PDF)于2012-02-08).
- Jeon JK, Uchimaru Y, Kim DP. Synthesis of novel amorphous boron carbonitride ceramics from the borazine derivative copolymer via hydroboration. Inorganic Chemistry. August 2004, 43 (16): 4796–8. PMID 15285647. doi:10.1021/ic035254a.
- Paetzold P. New perspectives in boron-nitrogen chemistry - I (PDF). Pure Appl. Chem. 1991, 63 (3): 345–350 [2023-01-25]. S2CID 53659373. doi:10.1351/pac199163030345. (原始内容存档 (PDF)于2012-07-16).
- Islas R. Borazine: to be or not to be aromatic. Structural Chemistry. 2007, 18 (6): 833–839. S2CID 95098134. doi:10.1007/s11224-007-9229-z.