氮烯

氮烯(Nitrene)也譯乃春、氮賓[1],是卡賓(碳烯)的氮類似物,通式R-N:。為活性中間體,參與多種化學反應。[2][3]其中氮周圍有6個電子,具親電性。
電子組態
[編輯]在最簡單的亞氨基氮烯(:N-H)中,氮周圍的6個電子,其中2個與氫形成共價鍵,2個形成自由電子對,剩餘2個占據兩個簡併的p軌道。根據洪德規則,該物種基態為三線態,其中每個軌道中含一個電子。高能態則為單線態,電子對填滿一個軌道,留下一個空軌道。
氮烯與卡賓類似,計算得到的其氮原子的自旋密度與從電子自旋共振得到的零場分裂參數(D)間有較強的關係。[4]體積小的氮烯如NH或CF3N的D值在1.8 cm−1左右,自旋密度則接近最大值2。另一方面,9-蒽基和9-菲基氮烯的D值只有不到0.4,自旋密度則為1.2-1.4。
合成
[編輯]氮烯為活性物種,很少分離出來。它可通過以下反應製得:
反應
[編輯]氮烯發生的典型反應有:
例:乙酸鈀(II)與2-苯基吡啶反應生成的中間體,其Pd-N鍵緊接著被氮烯(由氨基甲酸甲酯被過硫酸鉀氧化得到)插入,最終產物是N-(2-吡啶基苯基)氨基甲酸甲酯。[5]
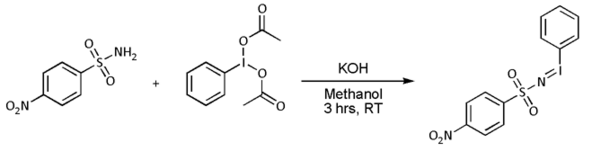
如下利用肟、乙酸酐構建異吲哚環系的過程可能也涉及氮烯中間體。[6]
- 環加成:氮烯與烯烴反應生成氮丙環衍生物。反應一般是以類氮烯(如對甲基苯磺醯亞胺碘苯(PhI=NTs)或對硝基苯磺醯亞胺碘苯(PhI=NNs))作為前體,但是烯烴在基於過渡金屬(如銅、鈀、金)的催化劑作用下直接與磺醯胺進行加成的例子也是已知的。[7][8][9][10][11]
類氮烯PhI=NNs可通過如下反應製取:
接下來發生氮烯轉移:
氮烯與金屬氮烯與烯烴發生直接的氮丙環化反應,不含金屬的類氮烯則通常與烯烴按照加成-消除機理進行反應。只有單線態氮烯可與1,2-二取代烯烴進行立體專一性的加成;三線態氮烯的反應無立體選擇性。[12]
- 芳基氮烯的擴環與縮環:擴環產生含累積雙鍵的7元環,縮環生成氰基取代的5元環,等等。
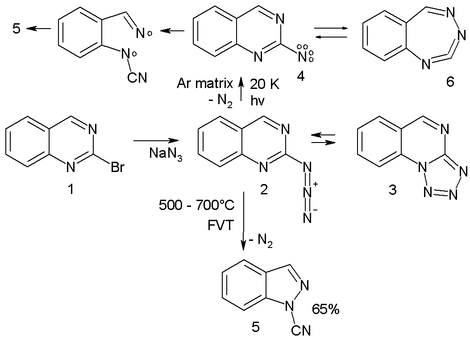
例:20K下固氬基質中的疊氮化物(2),經光解放出氮氣生成三線態氮烯(4,通過電子自旋共振與紫外-可見光譜確定)。4與擴環產物6形成平衡。[4]
該氮烯最終經雙自由基中間體(7)轉變為縮環產物腈(5)。利用瞬間真空熱解技術在500-600°C處理該疊氮化物,同樣以65%產率得到腈(5)。[13]
參考資料
[編輯]- ^ 全國科學名詞審定委員會[永久失效連結]
- ^ W. Lwowski, Ed (1970). Nitrenes. Interscience. New York.
- ^ C. Wentrup (1984). Reactive Intermediates. Wiley. New York.
- ^ 4.0 4.1 David Kvaskoff, Pawel Bednarek, Lisa George, Kerstin Waich, and Curt Wentrup. Nitrenes, Diradicals, and Ylides. Ring Expansion and Ring Opening in 2-Quinazolylnitrenes. J. Org. Chem. 2006, 71 (11): 4049–4058. doi:10.1021/jo052541i.
- ^ Hung-Yat Thu, Wing-Yiu Yu, and Chi-Ming Che. Intermolecular Amidation of Unactivated sp2 and sp3 C-H Bonds via Palladium-Catalyzed Cascade C-H Activation/Nitrene Insertion. J. Am. Chem. Soc. 2006, 128 (28): 9048–9049. doi:10.1021/ja062856v.
- ^ Cécile G. Savarin, Christiane Grisé, Jerry A. Murry, Robert A. Reamer, and David L. Hughes. Novel Intramolecular Reactivity of Oximes: Synthesis of Cyclic and Spiro-Fused Imines. Org. Lett. 2007, 9 (6): 981–983. doi:10.1021/ol0630043.
- ^ Zigang Li, Xiangyu Ding, and Chuan He. Nitrene Transfer Reactions Catalyzed by Gold Complexes. J. Org. Chem. 2006, 71 (16): 5876–5880. doi:10.1021/jo060016t.
- ^ David A. Evans, Margaret M. Faul, and Mark T. Bilodeau. Development of the Copper-Catalyzed Olefin Aziridination Reaction (PDF). J. Am. Chem. Soc. 1994, 116 (7): 2742–2753. doi:10.1021/ja00086a007. (原始內容 (PDF)存檔於2005-03-08).
- ^ Peter Brandt, Mikael J. Sodergren, Pher G. Andersson, and Per-Ola Norrby. Mechanistic Studies of Copper-Catalyzed Alkene Aziridination. J. Am. Chem. Soc. 2000, 122 (3): 8013–8020. doi:10.1021/ja993246g.
- ^ Iain D. G. Watson, Lily Yu, and Andrei K. Yudi. Advances in Nitrogen Transfer Reactions Involving Aziridines. Acc. Chem. Res. 2006, 39 (3): 194–206. doi:10.1021/ar050038m.
- ^ 反應物為順(或反)式二苯乙烯,氮烯前體為對硝基苯磺醯胺,反應中被二乙酸碘苯氧化。金催化劑基於一三聯吡啶三齒配體。
- ^ edited by Andrei K. Yudin (2007). Aziridines and Epoxides in Organic Synthesis. Wiley-VCH. pp. 120. ISBN 3-527-31213-7.
- ^ 喹唑啉衍生物通過相應的溴代物與疊氮化鈉反應製取。有機疊氮化物與四唑(3)形成平衡。
|