2-甲基四氢呋喃:修订间差异
外观
删除的内容 添加的内容
Shamrockwikiedit(留言 | 贡献) 新有機化合物條目 |
(没有差异)
|
2022年2月7日 (一) 02:55的版本
| 2-甲基四氢呋喃 | |
|---|---|

| |
| IUPAC名 2-Methyloxolane | |
| 别名 | 2-Methyltetrahydrofuran, 2-Methyl-THF |
| 识别 | |
| CAS号 | 96-47-9(外消旋體) 63798-13-0(R) 63798-12-9(S) |
| PubChem | 7301 |
| ChemSpider | 7028 |
| SMILES |
|
| InChI |
|
| InChIKey | JWUJQDFVADABEY-UHFFFAOYAM |
| UN编号 | 2536 |
| 性质 | |
| 化学式 | C5H10O |
| 摩尔质量 | 86.13 g·mol−1 |
| 密度 | 0.854 g/mL |
| 熔点 | -136 °C(137 K) |
| 沸点 | 80.2 °C(353 K) |
| 危险性 | |
GHS危险性符号  
| |
| GHS提示词 | 警告 |
| H-术语 | H225, H302, H315, H318, H319, H335, H336 |
| P-术语 | P210, P233, P240, P241, P242, P243, P261, P264, P270, P271, P280, P301+312, P302+352, P303+361+353 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
2-甲基四氫呋喃 (簡稱:2-MeTHF)是一具分子式C5H10O的有機化合物。其在常溫常壓下為一高度可燃的流動液體。相較於四氫呋喃,其可用於更高溫的化學反應,且不與水互溶,故2-甲基四氫呋喃可作為四氫呋喃的替代物。 2-甲基四氫呋喃可由醣類生成糠醛中間產物後催化氫化製得。2-甲基四氫呋喃有時被售為生物燃料.[1]
結構和性質
2-甲基四氫呋喃在水中溶解度會隨溫度的上升而減低,為較少見的性質。[2] 與四氫呋喃相似,2-甲基四氫呋喃也可在有機金屬反應中作為路易斯鹼。[3] 2-甲基四氫呋喃的合成通常會生成外消旋體。
製備方式
2-甲基四氫呋喃通常由糠醛的催化氫化製得。[4]
糠醛可由生物質中酸催化分解 五碳醣單體組成的多醣產生。 因此, 2-甲基四氫呋喃的原料為可再生,富有纖維素、 半纖維素和木質素的生物質, 如玉米穗軸或甘蔗渣,以及其他植物和農業廢棄物。[5]
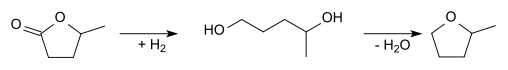
2-甲基四氫呋喃也可以乙醯丙酸作為起始原料. 經環化和還原反應後可製得 γ-戊內酯:
γ-戊內酯可被氫化成1,4-戊二醇, 並經脫水後生成 2-甲基四氫呋喃:
參考資料
- ^ Leal Silva, Jean Felipe; Mariano, Adriano Pinto; Maciel Filho, Rubens. Economic potential of 2-methyltetrahydrofuran (MTHF) and ethyl levulinate (EL) produced from hemicelluloses-derived furfural. Biomass and Bioenergy. 2018, 119 (December 2018): 492–502. doi:10.1016/j.biombioe.2018.10.008.
- ^ Sicaire, Anne-Gaëlle; Vian, Maryline Abert; Filly, Aurore; Li, Ying; Bily, Antoine; Chemat, Farid, Chemat, Farid; Vian, Maryline Abert , 编, 2-Methyltetrahydrofuran: Main Properties, Production Processes, and Application in Extraction of Natural Products, Alternative Solvents for Natural Products Extraction (Berlin, Heidelberg: Springer Berlin Heidelberg), 2014: 253–268, ISBN 978-3-662-43627-1, doi:10.1007/978-3-662-43628-8_12 (英语)
- ^ Aycock, David F. Solvent Applications of 2-Methyltetrahydrofuran in Organometallic and Biphasic Reactions. Org. Process Res. Dev. 2007, 11: 156–159. doi:10.1021/op060155c.
- ^ Huber, GW; Iborra, S; Corma, A. Synthesis of transportation fuels from biomass: chemistry, catalysts, and engineering. Chem. Rev. September 2006, 106 (9): 4044–98. PMID 16967928. doi:10.1021/cr068360d. ref 306
- ^ Hoydonckx, H. E.; Van Rhijn, W. M.; Van Rhijn, W.; De Vos, D. E.; Jacobs, P. A., Furfural and Derivatives, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, 2005, doi:10.1002/14356007.a12_119.pub2