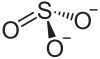
亚硫酸钡
外观
| 亚硫酸钡 | ||
|---|---|---|
|
| ||
| IUPAC名 亚硫酸钡 | ||
| 识别 | ||
| CAS号 | 7787-39-5 | |
| PubChem | 516931 | |
| ChemSpider | 450991 | |
| SMILES |
| |
| InChI |
| |
| InChIKey | ARSLNKYOPNUFFY-NUQVWONBAA | |
| 性质 | ||
| 化学式 | BaSO3 | |
| 摩尔质量 | 217.391 g·mol⁻¹ | |
| 外观 | 白色晶体 [1] | |
| 密度 | 4.44 g/cm3[1] | |
| 溶解性(水) | 0.0011 g/100 mL[1] | |
| 溶解性 | 不溶于酒精[1] | |
| 结构 | ||
| 晶体结构 | 单斜 [1] | |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | ||
亚硫酸钡是钡的亚硫酸盐,分子式为BaSO3。它是白色粉状物,可以用于造纸。像其他的钡化合物一样,它是有毒的。[2]它是通过碳热反应把硫酸钡还原成硫化钡的中间体。[3]
- BaSO4 + CO → BaSO3 + CO2
制备
[编辑]性质
[编辑]物理性质
[编辑]亚硫酸钡是一种白色无臭固体,不可燃,难溶于水,[6]易溶于酸。[7]它是单斜晶系的,[8]不过三斜晶系的亚硫酸钡也是已知的。[9]
化学性质
[编辑]在没有空气的情况下退火时,亚硫酸钡会分解成硫酸钡和硫化钡。[7]
危险性
[编辑]亚硫酸钡的LD50为375mg/kg。它对皮肤和眼睛有刺激性。虽然亚硫酸钡不可燃,但它加热分解会产生有害的硫氧化物气体。它与酸反应,放出二氧化硫[11]。
参考文献
[编辑]- ^ 1.0 1.1 1.2 1.3 1.4 CRC Handbook of Chemistry and Physics 97th Edition. 2016-06-24: 4–50. ISBN 1-4987-5428-7 (英语).
- ^ barium sulfite. Answers.com. McGraw-Hill Dictionary of Scientific and Technical Terms, McGraw-Hill Companies, Inc., 2003. http://www.answers.com/topic/barium-sulfite (页面存档备份,存于互联网档案馆), accessed July 19, 2009.
- ^ Kresse, Robert; Baudis, Ulrich; Jäger, Paul; Riechers, H. Hermann; Wagner, Heinz; Winkler, Jochen; Wolf, Hans Uwe, Ullmann's Encyclopedia of Industrial Chemistry, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, 2005, doi:10.1002/14356007.a03_325.pub2
- ^ D. Van Nonstrant Company. Elementary General Chemistry.
- ^ C. Saint-Pierre: "Sur la décomposition spontanée de divers bisulfites" in Compt. Rend. Hebd. 1872, 74, S. 52–53. Volltext
- ^ Record of CAS RN 7787-39-5 in the GESTIS Substance Database from the IFA
- ^ 7.0 7.1 R. Abegg, F. Auerbach: Handbuch der anorganischen Chemie, Verlag S. Hirzel, Bd. 2, 1908. S. 270; Volltext
- ^ Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997, ISBN 978-3-540-60035-0, S. 330. .
- ^ R. S. W. Braithwaite, A. R. Kampf, R. G. Pritchard, R. P. H. Lamb: "The occurrence of thiosulfates and other unstable sulfur species as natural weathering products of old smelting slags" in Mineralogy and Petrology 1993, 47(2-4), S. 255–261. doi:10.1007/BF01161570
- ^ A. Classen, O. Bauer: "Ueber die Anwendbarkeit des Wasserstoffsuperoxyds in der analytischen Chemie" in Berichte der deutschen chemischen Gesellschaft 1883, S. 1061–1074. Volltext
- ^ 化学物質等安全データシート(昭和化学株式会社) (PDF). [2021-08-03]. (原始内容 (PDF)存档于2021-08-03).