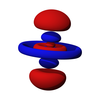
σ轨道
外观

在化学与原子物理学中,σ轨域(英语:σ orbital、sigma orbital)是一种分子轨域。是形成σ键后所产生的分子轨域。
σ轨域是一种由轨域端对端重叠所形成的新轨域。重叠的轨域可以是s轨域如H2,也可以是p轨域,如F2。
结构
[编辑]
σ轨域是两个原子的s轨域或两个原子pz轨域相互作用结果,如果轨域相对于连接两个核中心,核间轴的轴线是对称的。这意味著,分子轨域的旋转与核间轴不会导致相位变化有关。
σ*轨域
[编辑]σ*轨域是σ轨域的反键轨域,当核轴转时也有相同的相位。σ*轨域有一个波节,其位于原子核与核轴间的垂直平面。[1]
表示法
[编辑]将形成此轨域原来的轨域写在σ后面并下标,例如σ1s轨域是从原子的1s轨域键结所形成的。此外,如果组合得到的分子轨域能量比组合前原子轨域能量之和高,即原子核间电子云密度减小,则称作反键轨域,以*标注,计为σ*轨域。此外,两个原子核的中点对于对称σ轨域为σg轨域,以σu代表反对称的σ轨域。
σ键
[编辑]σ键是价键理论和分子轨域理论中一种化学键的名称。由两个相同或不相同的原子轨域沿轨道对称轴方向相互重叠而形成的共价键,叫做σ键。一般的“单键”都属于这种σ键,所形成的轨域则为σ轨域,比如C-H, O-H, N-H, C-C, C-Cl等等。
参见
[编辑]参考文献
[编辑]- ^ Catherine E. Housecroft, Alan G, Sharpe, Inorganic Chemistry, Pearson Prentice Hall; 2nd Edition, 2005, p. 29-33.