乙胺硝酸盐
外观
| 乙胺硝酸盐 | |||
|---|---|---|---|
| |||
| 别名 | 硝酸乙铵 | ||
| 识别 | |||
| CAS号 | 22113-86-6 | ||
| PubChem | 6432248 | ||
| ChemSpider | 4937507 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | AHRQMWOXLCFNAV-IKLDFBCSAI | ||
| 性质[3] | |||
| 化学式 | C 2NH 8NO 3 | ||
| 摩尔质量 | 108.0965 g·mol⁻¹ | ||
| 外观 | 无色液体 | ||
| 密度 | 1.261 g/ml | ||
| 熔点 | 8 °C(281 K)[1] 13 °C(286 K)[2] | ||
| 沸点 | 240 °C(513 K)[2] | ||
| 热力学 | |||
| 热容 | 206 J K−1 mol−1 | ||
| 危险性 | |||
| 警示术语 | R:R36/37/38 | ||
| 安全术语 | S:S24/25 S37/39 | ||
| MSDS | [1] | ||
| 主要危害 | 刺激性 | ||
| 相关物质 | |||
| 其他阳离子 | 甲胺硝酸盐 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
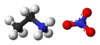
乙胺硝酸盐或乙基硝酸铵[4] (EAN) 是一种具有示性式的盐。它是一种无味、无色至微黄色的液体,其熔点为 12 ℃。 [5]这种化合物的性质最早于1914年由保罗·瓦尔登描述。 [6] [7]此化合物被认为是最早被发现的室温离子液体。 [8]
合成方式与性质
[编辑]乙基硝酸铵可以通过将硝酸乙酯与氨的醇溶液[9]或通过乙胺与浓硝酸混合反应来制备。 [7]它在 25 ℃时具有相对较低的粘度为 0.28泊和约 20 mS·cm -1 的高电导率 。其沸点是240 °C 并会在约 250℃ 时分解 。 其密度在 20 °C 为 1.261 克/厘米3 。 [10]
乙铵离子()具有三个易于分离的质子,它们以四面体形式排列在中心氮原子周围,而硝酸根(NO−
3)阴离子形状是平面的。尽管存在结构差异, EAN 与水具有许多相同的性质,例如胶束形成模式、促进碳氢化合物的聚集、气体溶解为负焓和负熵反应。与水类似地,EAN 可以形成三维氢键网络。 [11]
应用
[编辑]乙基硝酸铵在电化学领域中可做为可导电的溶剂和蛋白质结晶剂。 [12] [13]对变性溶菌酶的恢复活性有正向作用,恢复活性的比率可达90%左右。重折叠作用解释如下:乙基硝酸铵的乙基与蛋白质的疏水部分相互作用,从而保护其免受分子间缔合,而 EAN 的带电部分可稳定静电荷相互作用。 [14]
参考资料
[编辑]- ^ Samuel Sugden, Henry Wilkins. CLXVII.—The parachor and chemical constitution. Part XII. Fused metals and salts. J. Chem. Soc. 1929, 0 (0): 1291–1298 [2021-07-05]. ISSN 0368-1769. doi:10.1039/JR9290001291 (英语).
- ^ 2.0 2.1 Jean-Philippe Belieres, C. Austen Angell. Protic Ionic Liquids: Preparation, Characterization, and Proton Free Energy Level Representation †. The Journal of Physical Chemistry B. 2007-05, 111 (18): 4926–4937 [2021-07-05]. ISSN 1520-6106. doi:10.1021/jp067589u. (原始内容存档于2019-10-05) (英语).
- ^ Ionic liquids & ionic liquid acids with high temperature stability for fuel cell and other high temperature applications, method of making and cell employing same (页面存档备份,存于互联网档案馆) United States Patent Application 20070026295, Google patents link
- ^ Wagaman, Kerry L Liquid monopropellant (页面存档备份,存于互联网档案馆) United States Patent 6001197, Publication Date 12/14/1999
- ^ Marsh, K.N.; Boxall, J.A.; Lichtenthaler, R. Room temperature ionic liquids and their mixtures—a review. Fluid Phase Equilibria. 2004, 219: 93–98. doi:10.1016/j.fluid.2004.02.003.
- ^ P. Walden. Chem. Zentralbl. 1914, 85: 1800–1801. 缺少或
|title=为空 (帮助) - ^ 7.0 7.1 P. Walden. Ueber die Molekulargrösse und elektrische Leitfähigkeit einiger geschmolzenen Salze (PDF). Bull. Acad. Imper. Sci. St. Pétersbourg. 6. 1914, 8: 405–422.
- ^ Mihkel Koel. Ionic Liquids in Chemical Analysis. CRC Press. 2008: xxvii [2021-07-05]. ISBN 978-1-4200-4646-5. (原始内容存档于2021-07-09).
- ^ Rudolph Fittig. Wohler's Outlines of Organic Chemistry. Read Books. 2008: 56 [2021-07-05]. ISBN 978-1-4097-9043-3. (原始内容存档于2021-07-09).
- ^ Safety Data Sheet (PDF). Carlroth. [19 September 2016]. (原始内容 (PDF)存档于2016-09-19).
- ^ Allen, Martin; Evans, D. Fennell; Lumry, Rufus. Thermodynamic properties of the ethylammonium nitrate + water system: Partial molar volumes, heat capacities, and expansivities. Journal of Solution Chemistry. 1985, 14 (8): 549. doi:10.1007/BF00649520.
- ^ Garlitz, Jennifer A.; Summers, Catherine A.; Flowers, Robert A.; Borgstahl, Gloria E. O. Ethylammonium nitrate: a protein crystallization reagent. Acta Crystallographica D. 1999, 55 (12): 2037–8. PMID 10666583. doi:10.1107/S0907444999011774.
- ^ M. Riad Manaa. Chemistry at extreme conditions. Elsevier. 2005: 441 [2021-07-05]. ISBN 0-444-51766-9. (原始内容存档于2021-07-09).
- ^ Jochen Decker, Udo Reischl. Molecular diagnosis of infectious diseases. Humana Press. 2004: 247 [2021-07-05]. ISBN 1-58829-221-5. (原始内容存档于2021-08-04).


![{\displaystyle {\ce {[C2H5NH3]+NO3-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ef1f447da5b26c9bcc5930647a85c638a9747d26)
![{\displaystyle {\ce {[C2H5NH3]+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2ba53b8e20e641c7c907f585ca16ef9adb92dc66)