膠束
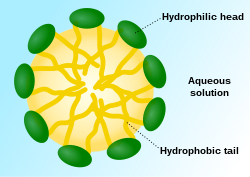
膠束(micelle)又稱膠團、微胞、微團,是表面活性劑在溶液中的濃度到達及超過臨界膠束濃度CMC後,其分子或離子自動締合成的膠體大小的聚集體質點微粒,這種膠體質點與離子之間處於平衡狀態。漢語膠束的束,是「小捆、一把」的意思,因其不一定呈球(團)狀,隨濃度不同亦可為棒狀、層狀、塊狀。
單個表面活性劑分子在溶於水後,完全被水分子包圍,分子中的親水基團有被水吸引的趨勢,而親油基團則被水排斥,因此表面活性劑分子占據溶液表面,在表面吸附,將其親油基團伸向空氣。這種表面吸附達到飽和後,如果表面活性劑的濃度繼續增加,則溶液內部的表面活性劑分子將採取另一種對水進行排斥的方式,即分子中的長鏈親油基團通過分子間吸引力相互締合,自身相互抱成團,而親水基團則伸向水中,與水分子結合,形成聚集體,即膠束。
膠束一般為球、柱、片等形狀,其結構問題至今仍未完全搞清。從實驗數據可知,當表面活性劑溶液的濃度達到一定值後膠束開始形成,濃度越大形成的膠束越多。膠束開始明顯形成時溶液中表面活性劑的濃度稱為臨界膠束濃度(Critical micelle concentration),記作CMC。臨界膠束濃度是表面活性劑的重要參數之一,它可以通過理論推算,也可以通過表面張力法、電導法、折光指數法和染料增溶法等來測定。
在臨界膠束濃度前後,表面活性劑濃度的許多物理性質,如電導率、滲透壓、光學性質、去污能力、表面張力等,都發生顯著變化,故在使用表面活性劑時必須超過CMC值,才能充分發揮表面活性劑的性能。多數表面活性劑的CMC值在0.001-0.02 mol/L左右。
在離子型表面活性劑的溶液中,單個表面活性劑離子與膠束之間可以形成平衡,該平衡受表面活性劑的濃度影響,當濃度較小時,溶液中主要是單個表面活性劑離子;當濃度較大或接近CMC時,溶液中將有少量膠束,如二聚體或三聚體等;當濃度10倍於CMC或更大時,膠束一般不是球形。
歷史
[編輯]1912年,布里斯托大學的James William McBain在大量實驗數據的基礎上提出,表面活性劑濃度大到一定程度後出現的反常現象,是由於表面活性劑離子或分子締合成膠體大小的聚集體所導致的。[1]G. S. Hartley在其所著的「Paraffin Chain Salts, A Study in Micelle Formation」一書中首先用Micelle一詞來形容表面活性劑分子或離子形成的此類聚集體。[2]
Micelle 一般讀作 /maɪˈsɛl/("my sell"),複數為 micelles;又拼作 micella,讀作 /maɪˈsɛlə/,複數為 micellae;其語源自拉丁字 mica,「顆粒」之義,加上指小詞綴 ‑elle,表示「微小顆粒」。
