邁耶-舒斯特重排反應
Meyer-Schuster重排反應(Meyer-Schuster rearrangement)
酸催化的炔丙醇至α,β-不飽和酮的重排反應。[1][2][3]

反應中可用的酸催化劑可以是乙酸、硫酸或鹽酸等。鹼催化的類似反應為Favorskii反應。
反應機理
[編輯]
本反應的機理[4]始於質子化的醇以E1消除的方式從炔烴離去形成雙烯中間體。隨後水分子進攻碳正離子並失去質子,最後發生互變異構得最終產物α,β不飽和羰基化合物。
Edens等[5]曾對該反應進行過研究並發現其具有三個主要步驟:(1)羥基氧原子的質子化(快);(2)質子化羥基的離去並伴隨着接下來的1,3-遷移(慢,決速步驟);(3)酮-烯醇互變並立即失去質子(快)
在對邁耶-舒斯特反應決速步驟的研究中,Andres等人指出[6]本反應的驅動力在於經由碳鎓離子形成不飽和羰基化合物過程中的不對稱性。他們還發現本反應會受到溶劑的協同作用。Tapia等人對溶劑協同作用做出了進一步的研究[7],指出溶劑的籠效應穩定了過渡態。
Rupe重排
[編輯]如果參加反應的醇為乙炔基醇,則不會得到預期的醛,而會通過烯炔中間體生成α,β-不飽和甲基酮。[8][9]該反應與Meyer-Schuster反應為競爭反應(如下圖所示,左邊為Meyer-Schuster產物,右邊為Rupe產物)。

反應使用的催化劑
[編輯]傳統上使用強酸作為Meyer-Schuster反應的催化劑,由於條件劇烈,在反應物為叔醇的情況下會發生競爭反應Rupe重排。以過渡金屬為中心原子的路易斯酸催化劑(如Ru[10]和Ag[11])已研究成功,反應條件較為溫和。Cadierno等人報道在微波條件下使用InCl作為催化劑,在很短的反應時間內獲得了很高的產率並具有很好的立體選擇性.[12]以下是文中的一個實例:

應用
[編輯]Meyer-Schuster反應有着廣泛的應用,如以γ-硫取代烯丙醇為原料合成α,β-不飽和硫醚的過程中,需要使用PTSA作為催化劑將ω-炔基-ω-羥甲基內酯轉化為烯酰胺[13];其他的應用還有如在溫和酸性條件下3-炔基-3-羥基-1H-異吲哚重排為α,β-不飽和羰基化合物[14]。最有趣的一個應用是在合成紫杉醇的一個片段的過程中採用非對映異構的合成方法使得產物得到單一的E-烯烴[15]。
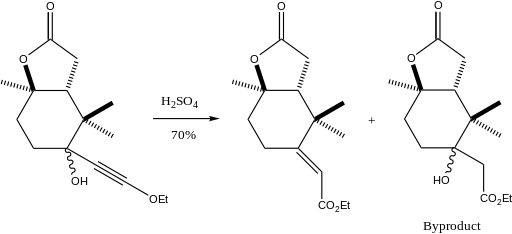
該步產率大於70%(如果計入在其他步驟中可以通過Meyer-Schuster轉化的副產物則產率可達91%)。作者選用Meyer-Schuster重排的原因是他們希望在不破壞分子其餘部分的前提下將一個有位阻的酮轉化為烯。
參見
[編輯]參考資料
[編輯]- ^ Meyer, K. H.; Schuster, K. Ber. 1922, 55, 819.
- ^ Swaminathan, S.; Narayan, K. V. "The Rupe and Meyer-Schuster Rearrangements" Chem. Rev. 1971, 71, 429–438.(Review)
- ^ Vartanyan, S. A.; Banbanyan, S. O. Russ. Chem. Rev. 1967, 36, 670.(Review)
- ^ Li, J.J. In Meyer-Schuster rearrangement; Name Reactions: A Collection of Detailed Reaction Mechanisms; Springer: Berlin, 2006; pp 380-381.(doi:10.1007/978-3-642-01053-8_159)
- ^ Edens, M.; Boerner, D.; Chase, C. R.; Nass, D.; Schiavelli, M. D. J. Org. Chem. 1977, 42, 3403-3408. (doi:10.1021/jo00441a017)
- ^ Andres, J.; Cardenas, R.; Silla, E.; Tapia, O. J. Am. Chem. Soc. 1988, 110, 666-674. (doi:10.1021/ja00211a002)
- ^ Tapia, O.; Lluch, J.M.; Cardena, R.; Andres, J. J. Am. Chem. Soc. 1989, 111, 829-835. (doi:10.1021/ja00185a007)
- ^ Rupe, H.; Kambli, E. Helv. Chim. Acta 1926, 9, 672. (doi:10.1002/hlca.19260090185)
- ^ Li, J.J. In Rupe rearrangement; Name Reactions: A Collection of Detailed Reaction Mechanisms; Springer: Berlin, 2006; pp 513-514.(doi:10.1007/978-3-642-01053-8_224)
- ^ Cadierno, V.; Crochet, P.; Gimeno, J. Synlett 2008, 1105-1124. (doi:10.1055/s-2008-1072593)
- ^ Sugawara, Y.; Yamada, W.; Yoshida, S.; Ikeno, T.; Yamada, T. J. Am. Chem. Soc. 2007, 129, 12902-12903. (doi:10.1021/ja074350y)
- ^ Cadierno, V.; Francos, J.; Gimeno, J. Tetrahedron Lett. 2009, 50, 4773-4776.(doi:10.1016/j.tetlet.2009.06.040)
- ^ Chihab-Eddine, A.; Daich, A.; Jilale, A.; Decroix, B. J. Heterocycl. Chem. 2000, 37, 1543-1548.(doi:10.1002/jhet.5570370622)
- ^ Omar, E.A.; Tu, C.; Wigal, C.T.; Braun, L.L. J. Heterocycl. Chem. 1992, 29, 947-951.(doi:10.1002/jhet.5570290445)
- ^ Crich, D.; Natarajan, S.; Crich, J.Z. Tetrahedron 1997, 53, 7139-7158.(doi:10.1016/S0040-4020(97)00411-0)

